
【题目】下列变化中,既有旧化学键断裂,又有新化学键形成的是( )
A.酒精溶解于水B.氯化钠受热熔融
C.碘单质受热产生紫色气体D.碳酸氢铵受热产生刺激性气味
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 摩尔是物质的量的单位
B. 电子转移是氧化还原反应的本质
C. 熔融状态下或水溶液中能导电的化合物称为电解质
D. 得电子的物质被还原,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,1 mol水占的体积是22.4 LB.1 mol H+的质量是1 g
C.1 L 1 mol/L盐酸溶液中,有1molHCl分子D.二氧化硫的摩尔质量是64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的说法中,正确的是
A. 热稳定性:Na2CO3< NaHCO3
B. Na2CO3粉末中混有NaHCO3时可用加热的方法除去
C. 用氢氧化钙溶液鉴别Na2CO3和NaHCO3两种溶液
D. Na2CO3溶液和NaHCO3,溶液分别加入CaCl2溶液,都产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图,实验桌上放置的两容器中有等体积的甲、乙两种液体。几天后,两者的体积都明显减少,且甲比乙减少得多。由此现象得出的正确结论是( )
甲 乙
A.甲比乙易挥发
B.甲的沸点比乙高
C.甲的熔点比乙小
D.甲与乙都能挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅣA族的碳、硅等元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)在基态14C 原子中,核外存在__________对自旋相反的电子;CO32- 离子的几何构型为__________。
(2)利用反应Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl 可检验乙炔。乙炔分子中σ键与π键数目之比为__________,NH4Cl 中含有的化学键类型有__________。
(3)“分子机器设计和合成”的研究对象之一为“分子开关”,“分子开关”与大环主体分子苯芳烃、杯芳烃等有关。
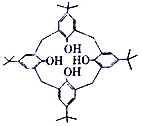
①右图为对叔丁基杯[4]芳烃,由4 个羟基构成杯底,羟基间的相互作用力是__________。对叔丁基杯[4]芳烃中碳原子的杂化方式有__________。
②杯芳烃可用于某些ⅢB族元素金属离子如57La3+及21Se2+ 的萃取,基态Se2+核外电子排布式为__________。
(4)硅、硒均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se__________(填“>”或“<”)Si。
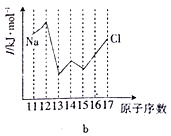
与Si同周期的部分元素的电离能(I)如图所示,其中代表第二电离能的图是__________(填标号)。


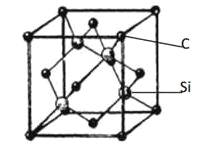
(5)金刚砂(SiC)的晶胞结构如下图所示,每个C原子周围距离最近的C原子数目为__________个;若晶胞的边长为a pm,则金刚砂的密度表达式为__________g · cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
A.28g乙烯所含共用电子对数目为4NA
B.0.5mol 1,3﹣丁二烯分子中含有C=C双键数为NA
C.1 mol羟基所含的电子总数为10NA
D.标准状况下,11.2 L己烷所含分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质中铁含量的测定方法是多种多样的.
土壤中铁含量的测定是先将Fe3+还原为Fe2+ , 然后使Fe3+与邻啡罗( 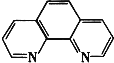 )结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OHHCl═4FeCl2+N2O↑+6HCl+H2O
)结合显橙红色,再用比色法测定.其中涉及反应:4FeCl3+2NH2OHHCl═4FeCl2+N2O↑+6HCl+H2O
(1)基态Fe2+的核外电子排布式为。
(2)羟胺(NH2OH)中氮.氧原子的杂化方式是。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com