
【题目】(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
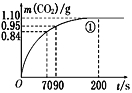
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1 | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
【答案】1.00 35 25 2.00 大理石规格 0.01 mol/(L·s) 0~70 5 30 ②和③ ①和② 0.025
【解析】
I.(1)(I)实验①和②探究浓度对反应速率的影响,硝酸的浓度应该不同;
(Ⅱ)实验①和③探究温度对反应速率的影响,温度应该不同;
(Ⅲ)中实验①和④,大理石的规格不同,则其它条件应该相同;
(2)先根据图象,求出生成二氧化碳的物质的量,然后根据反应:CaCO3+2HNO3=Ca(NO3)2+CO2↑H2O,求出消耗的硝酸的物质的量,再由v(HNO3)=![]() 求出反应速率,物质浓度越大,反应速率越快。
求出反应速率,物质浓度越大,反应速率越快。
II.(3)由控制变量法可知,应控制溶液的总体积相同;
(4)实验1、2的温度相同,实验2、3的浓度相同;
(5)结合v=![]() 、速率之比等于化学计量数之比计算。
、速率之比等于化学计量数之比计算。
(1)(I)由于①和②探究浓度对反应速率的影响,故硝酸的浓度不同,a应该是1.00mol/LHNO3;
(Ⅱ)由于①和③探究温度对反应速率的影响,故应该温度不同,b应该选35℃;
(Ⅲ)实验①和④的大理石规格不同,其它反应条件相同,探究的是固体物质的表面积对反应速率的影响,故c为25℃,d是2.00mol/L,e是固体物质的表面积,即大理石规格;
(2)由图可知70至90s,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=![]() =0.0025molmol,根据反应CaCO3+2HNO3=Ca(NO3)2+CO2↑H2O,可知消耗HNO3的物质的量为n(HNO3)=2×0.0025mol=0.005mol,又由于硝酸溶液体积为0.025L,所以HNO3减少的浓度△c(HNO3)=
=0.0025molmol,根据反应CaCO3+2HNO3=Ca(NO3)2+CO2↑H2O,可知消耗HNO3的物质的量为n(HNO3)=2×0.0025mol=0.005mol,又由于硝酸溶液体积为0.025L,所以HNO3减少的浓度△c(HNO3)=![]() =0.2mol/L,反应的时间t=90s-70s=20s,所以HNO3在70~90s范围内的平均反应速率为v(HNO3)=
=0.2mol/L,反应的时间t=90s-70s=20s,所以HNO3在70~90s范围内的平均反应速率为v(HNO3)=![]() =0.01mol/(Ls);在大理石与硝酸的反应中,随着反应的进行,硝酸的浓度逐渐减低,在0~70s、70s~90s、90s~200s各相同的时间段里,浓度最大的是0~70s,所以反应速率最大的时间段是0~70s;
=0.01mol/(Ls);在大理石与硝酸的反应中,随着反应的进行,硝酸的浓度逐渐减低,在0~70s、70s~90s、90s~200s各相同的时间段里,浓度最大的是0~70s,所以反应速率最大的时间段是0~70s;
Ⅱ.(3)实验2混合液的总体积为10mL+10mL+30mL=50mL,则V1=50mL-10mL-35mL=5mL,V2=50mL-10mL-10mL=30mL;
(4)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②;
(5)草酸的物质的量n(H2C2O4)=0.60mol/L×0.005L=0.003mol,高锰酸钾的物质的量n(KMnO4)=0.10molL-1×0.01L=0.001mol,草酸和高锰酸钾的物质的量之比为0.003mol:0.001mol=3:1,由2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可知草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度c(KMnO4)=![]() =0.02mol/L,这段时间内平均反应速率v(KMnO4)=
=0.02mol/L,这段时间内平均反应速率v(KMnO4)=![]() =0.01 mol/(Lmin),由速率之比等于化学计量数之比可知,这段时间内平均反应速率v(H2C2O4)=0.01mol/(Lmin)×
=0.01 mol/(Lmin),由速率之比等于化学计量数之比可知,这段时间内平均反应速率v(H2C2O4)=0.01mol/(Lmin)×![]() =0.025mol/(Lmin)。
=0.025mol/(Lmin)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚铁氰化钠晶体[Na4Fe(CN)6·10H2O,M=484g·mol-1]可用作食盐抗结剂。请回答
(1)向Na4Fe(CN)6溶液中滴入FeCl3溶液,出现蓝色沉淀,其离子方程式为______________。
(2)已知:Ag4Fe(CN)6为白色难溶物, Cu2Fe(CN)6为红棕色难溶物。市售亚铁氰化钠常含有Cl-杂质,选用下列试剂设计实验方案进行Cl-检验。
试剂:稀HNO3、稀H2SO4、AgNO3溶液、CuSO4溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③_______ | ④______ |
⑤静置,_____ | ⑥出现白色浑浊 |
(3)利用铈量法测定亚铁氰化钠晶体纯度的实验如下:称取1.2100g样品,置于500mL仪器a中,加入25mL除氧蒸馏水,加入25mL浓硫酸酸化并冷却,滴加3滴橘红色邻二氮菲(phen)—FeSO4指示剂,用0.1000mo1·L-1的Ce(SO4)2标准溶液滴定,发生反应:Ce4++[Fe(CN)6]4-=Ce3++[Fe(CN)6]3-。当溶液从橘红色变为淡黄色,即为终点。平行滴定3次,标准溶液的平均用量为24.50mL。
①仪器a的名称为_________________。
②“浓硫酸酸化”的实验操作为______________________
③样品纯度为__________________%
查看答案和解析>>
科目:高中化学 来源: 题型:
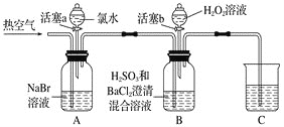
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
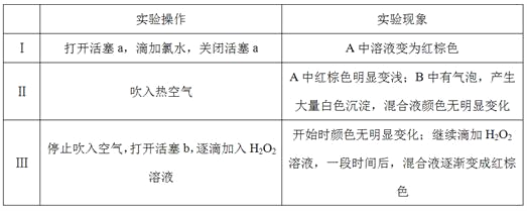
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是( )
A. Na和Fe B. Mg和Cu C. Al和Mg D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是_______。其它条件不变时,若再充入一定量的A, 则平衡向______________方向移动,A的消耗速率将____________;B的浓度将_________(后两个空填增大、减小、或 “不能确定”)。
(2)A、C是气体,增加B的量,平衡不移动,则B为__________态。
(3)B、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是_________。
(4)加热后,可使C的质量增加,则正反应是___________反应(放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
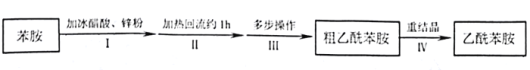
【题目】乙酰苯胺是用途广泛的化工原料,主要应用于医药、日用化工等诸多领域。某兴趣小组制备流程如下:
已知:
a.乙酰苯胺在水中的溶解度随温度的升高而增大
b.苯胺在空气中受热易被氧化
c.
名称 | 苯胺 | 醋酸 | 乙酰苯胺 |
沸点 | 184.4 | 117.9 | 304 |
d.反应原理:![]() +CH3COOH
+CH3COOH ![]()
![]() +H2O
+H2O
请回答:
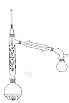
(1)步骤Ⅰ,加入锌粉的目的__________。
(2)步骤Ⅱ实验装置如图(加热装置省略),具体实验过程:装上一刺形分馏柱,插上温度计。用酒精灯加热,使反应溶液在微沸状态下回流,调节加热温度,使柱顶温度105℃左右,反应约![]() 。在反应瓶上装一个刺形分馏柱,其作用是__________。
。在反应瓶上装一个刺形分馏柱,其作用是__________。
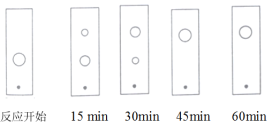
(3)步骤Ⅱ某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流![]() 、
、![]() 、
、![]() 和
和![]() 时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)步骤Ⅳ,关于重结晶的操作,下列说法正确的是________。
A.选蒸馏水作为重结晶提纯乙酰苯胺的溶剂
B.粗制的有机化合物中常常含有有色杂质,可用活性炭进行脱色
C.趁热过滤时,需将菊花形滤纸放入长颈玻璃漏斗,一并放入保温漏斗中
D.趁热过滤也可以用减压过滤代替,提前将布氏漏斗放在沸腾的水浴中加热,防止乙酰苯胺热溶液遇到冷的布氏漏斗而提前析出。
E.冷却结晶时一般是在室温下自然冷却。当溶液降至室温,析出大量乙酰苯胺晶体后,可用冰水进一步冷却,以便晶体析出更加彻底。
(5)物质制备时,通常对纯度有一定要求,从结构与性质角度分析,上述制备过程中“由非氧化还原反应”产生的杂质可能有__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像不符合反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
A. 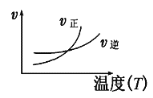 B.
B. 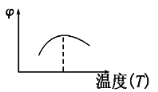
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅酸盐及无机非金属材料的说法正确的是
A. 硅酸钠属于盐,不属于碱,所以硅酸钠水溶液可以保存在磨口玻璃塞试剂瓶中
B. 反应①Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
C. 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D. 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.某同学做如下实验(如图),以检验反应中的能量变化。
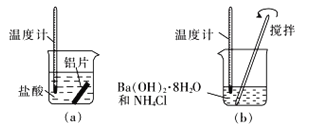
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是___(填“吸热”或“放热”)反应。
(2)(b)中温度降低,下列各图(如图)所表示的反应是(b)中反应的是_______。
a.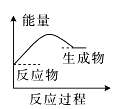 b.
b.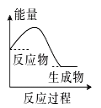 c.
c.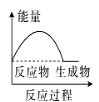 d.
d.
Ⅱ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
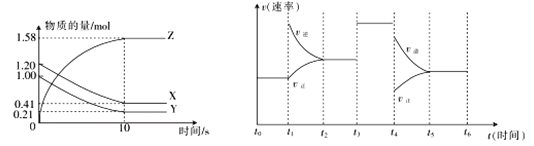
(3)从反应开始到10 s时,用Z表示的反应速率为___________,Y的转化率为________。
(4)若上述反应在10 s后的t1~t6内反应速率与反应时间的图像如图,在每一时刻均改变一个影响反应速率的因素,则t1时改变的因素为__________,t3时改变的因素为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com