
����Ŀ������ͨ���м�������Cu��Mg���γ�һ�ֳ�Ϊ��ά˹���MgCu2С���������ɢ��Al�п�ʹ�����ĵ�Ӳ�����ӡ���չ�Լ�С���γ���ν����������������ɻ�����Ҫ���ϡ��ش��������⣺
(1)����״̬��þ�У����������һ��������������������______________��
A��![]() B��
B��![]() C��
C��![]() D��
D��![]()
(2)�Ҷ���(H2NCH2CH2NH2)��һ���л�����������е���̼���ӻ����ͷֱ���_________��_________���Ҷ�������Mg2+��Cu2+�Ƚ��������γ��ȶ���״���ӣ��������Ҷ����γɵĻ������ȶ�����Խϸߵ���____________(����Mg2+������Cu2+��)��
(3)һЩ��������۵������ʾ��
������ | Li2O | MgO | P4O6 | SO2 |
�۵�/��C | 1570 | 2800 | 23.8 | 75.5 |
����MgO�۵��P4O6�۵�ߵö��ԭ��______________
(4)���ʯ�ľ�����ͼ�����Թ�ԭ�Ӵ�����ʯ�����е�̼ԭ�ӣ���õ�����裻�������ʯ������һ���̼ԭ�ӻ��ɹ�ԭ�ӣ���̼����ԭ�ӽ��棬���õ�̼���辧��(���ɰ)
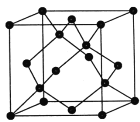
��̼���辧��(���ɰ)�Ļ�ѧʽ______________
�ڽ��ʯ������衢̼������۵��ɸߵ��͵�˳��Ϊ__________________
��������������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5 pm��������������ܶ���_____________g/cm3(�г�ʽ�Ӳ��������ӵ�����ΪNA)
���𰸡�A sp3 sp3 Cu2+ MgOΪ���Ӿ��壬P4O6���Ӿ��塣 SiC C(���ʯ)>SiC>Si 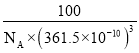
��������
(1)����Խ��Խ���ȶ���Խ��ʧ���ӣ����Լ���̬������ʧ���ӣ�ԭ�ӹ���д��ڰ���״̬ʱ���ȶ���
(2)ÿ��Nԭ���γɵĹ��ۼ���2��N-H����1��N-C�����һ�����1���µ��Ӷԣ�ÿ��Cԭ���γɵĹ��ۼ���2��C-H����2��C-N��������N��Cԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�N��Cԭ���ӻ����ͣ����йµ��ӶԵ�ԭ�Ӻͺ��пչ����ԭ��֮�����γ���λ���������������Ҷ����γɵĻ������ȶ��Խ�����
(3)���ݾ������ͼ�����������������С�����Ƚϣ�
(4)�ٸ���C��Siԭ���γɹ��ۼ���Ŀ���ռ乹�ͷ�����ѧʽ��
�ڸ��ݼ���Խ��������ԽС�����ʵ��۷е��Խ�ͱȽϣ�
�۸��ݽ��ʯ�ṹ����һ�������к��е�Cԭ����Ŀ�����ݶ��߽ṹ���ƣ���ϵ�����ѧʽ�ص��ȷ�������к��е�B��Nԭ����Ŀ�����㾧�������������Ȼ����ݾ����ܶ���=![]() ���㡣
���㡣
(1)A��D������Mgԭ��ʧȥһ�����Ӻ�õ��ģ�����D����������A���ȶ���A>D������ʧ��������A>D��B��C����ԭ�ӣ�����B�ǻ�̬��C�Ǽ���̬��������C>B���ȶ���B>C������ʧȥһ������������B>C��AΪMg+��BΪMgԭ�ӣ�A��ʧȥ����������������Mgԭ��ʧȥ2�����ӵ�������ΪMgԭ�ӵĵڶ������ܣ�Bʧȥһ�����ӵ�������Mgԭ�ӵĵ�һ�����ܣ���ڶ������ܴ��ڵ�һ�����ܣ����Ե��������һ��������������A>B��ͨ�����Ϸ���֪�����������һ��������������������A���ʺ���ѡ����A��
(2)���Ҷ���(H2NCH2CH2NH2)�У�ÿ��Nԭ���γɵĹ��ۼ���2��N-H����1��N-C�����һ�����1���µ��Ӷԣ�ÿ��Cԭ���γɵĹ��ۼ���2��C-H����2��C-N��������N��Cԭ�Ӽ۲���ӶԸ�������4�����ݼ۲���ӶԻ��������ж�N��Cԭ���ӻ����ͷֱ�Ϊsp3�ӻ���sp3�ӻ������йµ��ӶԵ�ԭ�Ӻͺ��пչ����ԭ��֮�����γ���λ�����Ҷ���������N�ṩ�¶Ե��Ӹ����������γ���λ���������Ҷ�������Mg2+��Cu2+�Ƚ��������γ��ȶ���״���ӣ������������Ҷ����γɵĻ������ȶ��Խ������������Ҷ����γɵĻ������ȶ�����Խϸߵ���Cu2+��
(3) Li2O�������Ӿ��壬����֮�������Ӽ���ϣ����Ӽ���һ��ǿ�ҵ�����ã��������Ľϸߵ�������������ʵ��۵�ϸߣ���P4O6���ڷ��Ӿ��壬����֮�������ķ��Ӽ���������ϣ��������Ľϵ����������P4O6�����۷е�Ƚϵͣ�
(4)���ڽ��ɰ�У�ÿ��Cԭ�������ڵ�4��Si�γɹ��ۼ���ÿ��Siԭ�������ڵ�4��Cԭ���γɹ��ۼ������ֽṹ��ռ���չ�����γ���������״�ṹ����˽��ɰ��Ӳ������ԭ�Ӹ�������1��1�������仯ѧʽ��SiC��
�����ڽ��ʯ������衢̼���趼��ԭ�Ӿ��壬ԭ��֮���Թ��ۼ���ϣ�����ԭ�Ӱ뾶C<Si�����Լ�����C-C<C-Si<Si-Si������Խ�̣�ԭ��֮��������Խǿ�����ܾ�Խ���ѹ��ۼ�ʹ�����ۻ����ĵ�������Խ�ߣ������������ʵ��۵��ɸߵ��͵�˳��Ϊ�����ʯ>̼����>����裻
���ڽ��ʯ������Cԭ�Ӵ����������8�����㣬6�����ģ�������4�������ʯ������̼ԭ����ĿΪ��4+8��![]() +6��
+6��![]() =8������������ṹ����ʯ���ƣ��侧������ʯ����������ͬԭ���������ɵ�����ѧʽBN����֪��һ�������и�����4��Bԭ�ӡ�4��Nԭ�ӣ���������m=4��
=8������������ṹ����ʯ���ƣ��侧������ʯ����������ͬԭ���������ɵ�����ѧʽBN����֪��һ�������и�����4��Bԭ�ӡ�4��Nԭ�ӣ���������m=4��![]() g�����������V=(361.5��10-10)3cm3����������������ܶ���=
g�����������V=(361.5��10-10)3cm3����������������ܶ���=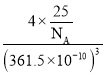 g/cm3=
g/cm3=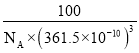 g/cm3��
g/cm3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ���ĸ�ԭ���װ�ã����н�����ȷ���ǣ�������
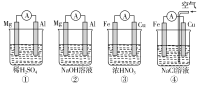
A.�٢���Mg���������ۢ���Fe������
B.����Mg���������缫��ӦʽΪ6H2O��6e��=6OH����3H2��
C.����Fe���������缫��ӦʽΪFe-2e��=Fe2��
D.����Cu���������缫��ӦʽΪ2H����2e��=H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L�����ܱ������г���1molA��1molB��������ӦA(g)+B(g) ![]() C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ��� ��
C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ��� ��
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.��Ӧ��ǰ5s��ƽ������V(A)=0.03mol/(L��s)
B.���������������䣬�����¶ȣ�ƽ��ʱc(A)=0.41mol��L-1����Ӧ����H>0
C.��ͬ�¶��£���ʼʱ�������г���2.0molC���ﵽƽ��ʱ��C�ķֽ��ʴ���80%
D.��ͬ�¶��£���ʼʱ�������г���0.2molA.0.2molB��1.0molC����Ӧ�ﵽƽ��ǰ��Ӧ����V������<V���棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�д���ƽ��Cl2+H2O![]() HCl+HClO��HClO
HCl+HClO��HClO![]() H++ClO-����ƽ���ҪʹHClOŨ�����ɼ��루 ��
H++ClO-����ƽ���ҪʹHClOŨ�����ɼ��루 ��
A.H2SB.NaHCO3C.����D.NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����(����)
A.��0.2 mol H2SO4��Ũ�����������ͭ��Ӧ��ת�Ƶ�����Ϊ0.2NA
B.25 ��ʱ��1 L pH��13��Ba(OH)2��Һ����ˮ���������OH������ĿΪ0.1NA
C.15 g HCHO�к���1.5NA�Թ��õ��Ӷ�
D.���³�ѹ�£�22.4 L���������к��е���ԭ����ĿС��4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�KOH��Һʱ������Ũ��ƫ�͵�ԭ�������(����)
A. �ó�����������KOH��ʱ�����
B. ����ǰ��������ƿ�м�����������ˮ
C. ����ƿʢ��KOH��Һ��ʹ��ǰδϴ��
D. �ܽ�����ת�Ƶ�����ƿ��Ȼ�����������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ������������������й㷺����
��1����������̬ԭ���γ�1mol��ѧ���ͷŵ������������֪���л�ѧ���ļ��������ʾ,д��1mol��̬�£�NH2-NH2��ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ_________
��ѧ�� | N��N | O=O | N-N | N-H | O-H |
����/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
��2���ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s) ![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO������������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO������������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO������������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�÷�ӦΪ_____________��������������������������Ӧ�������еķ�Ӧ��60minʱ�ﵽƽ��״̬����0-60min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����V��NO��=_________
��3���ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
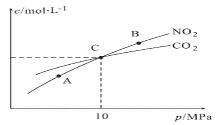
��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)_____________Kc(B)����������������������=������
��A��B��C������NO2��ת������ߵ���_____________������A������B������C�����㡣
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=____________��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ϵʽ����˵����ӦN2��3H2![]() 2NH3�Ѵﵽƽ��״̬����(����)
2NH3�Ѵﵽƽ��״̬����(����)
A. 3v��(N2)��v��(H2) B. v��(N2)��v��(NH3)
C. 2v��(H2)��3v��(NH3) D. v��(N2)��3v��(H2)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com