
【题目】丙氨酸的R基为-CH3,赖氨酸的R基为-C4H10N,由它们缩合成的二肽中含有的C、H、O、N的原子个数分别是
A. 9、21、4、3 B. 9、19、4、3
C. 9、19、3、3 D. 9、19、3、2
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO![]() )=6 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=6 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Na+)=6 mol
B.电解后得到的Cu的物质的量为2 mol
C.上述电解过程中共转移8 mol电子
D.电解后溶液中c(H+)=4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关SO2性质的探究活动。

(1)装置A中反应的离子方程式为 。
(2)选用图1以上装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是 。
②丙同学设计的合理实验方案为:按照A→C →尾气处理(填字母)顺序连接装置。其中装置C的作用是 。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是 。
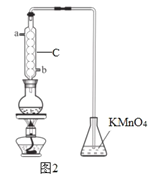
(3)利用如图2的装置A测残液中SO2的含量。量取10.00 mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00 mL 0.1000 mol/L的KMnO4标准溶液吸收。充分反应后,再用0.2000 mol/L的KI溶液滴定过量的KMnO4,消耗KI溶液25.00 mL。
(已知:5SO2+2MnO4-+2H2O==2Mn2++5SO42-+4H+,10I-+2MnO4-+16H+==2Mn2++5I2+8H2O)
①该装置中仪器C的名称为 ,水通入C的进口为_____________。
②残液中SO2的含量为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蛋白质由m条肽链、n个氨基酸组成。理论上该蛋白质至少含有氧原子
A. (n-m)个 B. ( n-2m)个 C. (n+m)个 D. (n+2m)个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
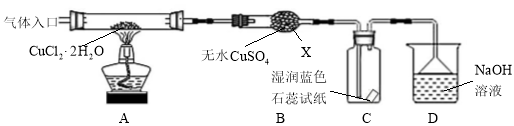
请回答下列问题:
(1)仪器X的名称是________________。
(2)实验操作的先后顺序是① → → → → ⑤。
①检查装置的气密性后加入药品
②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl
④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生反应的离子方程式是 。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
(6)若已证实杂质为CuO,请写出由Cu2(OH)2Cl 2生成CuO的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
A.Ag和AgCl溶液 B.Ag和AgNO3溶液 C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是( )
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是( )

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
A.v(NH3)=0.010 molL-1s-1 B.v(O2)=0.001 molL-1s-1
C.v(NO)=0.0010 molL-1s-1 D.v(H2O)=0.045 molL-1s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com