
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是( )
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是( )

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
【答案】D
【解析】
试题分析:A.2NO(g)+2CO(g)N2(g)+2CO2(g),先拐先平温度高,甲状态温度高于丙,T1>T2,此时甲平衡状态二氧化碳物质的量小,说明温度越高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,故A错误;B.乙中可以看做是甲起始量达到平衡状态,再加入0.1molNO和0.1molCO,相当于增大平衡压强,平衡正向进行,达到平衡时,乙中CO2的体积分数比甲中的大,故B错误;C.甲状态下平衡时CO物质的量为0.10mol,结合三行计算计算平衡常数,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) 0.05 0.05 0.025 0.05
平衡量(mol/L) 0.05 0.05 0.025 0.05
K=![]() =10,T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,Qc=
=10,T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,Qc=![]() =2.5<K=10.则反应达到新平衡前v(正)>v(逆),故C错误;D.T2℃时,平衡状态CO物质的量为0.12mol,
=2.5<K=10.则反应达到新平衡前v(正)>v(逆),故C错误;D.T2℃时,平衡状态CO物质的量为0.12mol,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 0.2 0.2 0 0
转化量(mol) 0 0 0.1 0.2
变化量(mol) 0.08 0.08 0.04 0.08
平衡量(mol) 0.12 0.12 0.04 0.08
2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 0 0 0.06 0.12
转化量 0.12 0.12 0 0
若起始时向丙中充入0.06mol N2和0.12 mol CO2,反应逆向进行得到平衡状态,和起始量为0.12molNO和0.12molCO达到的平衡相同,和起始量0.2molCO、NO相比,相当于减少了NO、CO0.08mol的CO、NO,压强减小平衡逆向进行,所以氮气转化率大于40%,故D正确;故选D。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)=2P2O5(s) ΔH=-a kJ/mol(a>0);4P(红磷,s)+5O2(g)=2P2O5(s) ΔH=-bkJ/mol(b>0),则a和b的关系是( )
A. a > b B. a = b C. a < b D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙氨酸的R基为-CH3,赖氨酸的R基为-C4H10N,由它们缩合成的二肽中含有的C、H、O、N的原子个数分别是
A. 9、21、4、3 B. 9、19、4、3
C. 9、19、3、3 D. 9、19、3、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
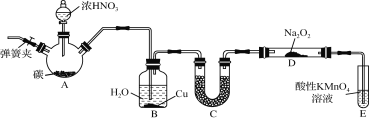
【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是
A. Na2O2是氧化剂,CO2是还原剂
B. Na2CO3是还原产物,O2是氧化产物
C. 每转移4摩尔电子,有1摩尔氧气生成,
D. 1摩尔CO2参加反应就会产生11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无 色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O

(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将其序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
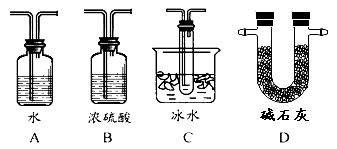
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用12.6gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了4.48g,则实验测得SO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com