
【题目】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
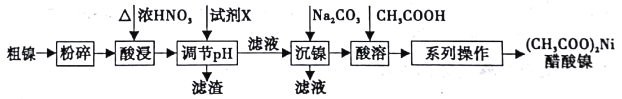
已知:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
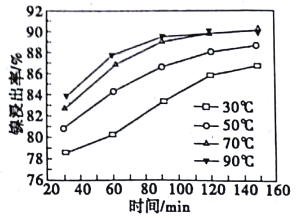
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。
(3)酸浸中Ni和浓硝酸反应的化学方程式为___________。
(4)加人试剂X为_____(填下列提供试剂的序号),可调节溶液pH至______(填pH范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)=2.0mol/L,若要处理1L该滤液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2位有效数字)
【答案】 增大固体接触面积,加快酸浸的速率 70 120 Ni+4HNO3(浓)=Ni(NO3)2+2NO2↑+2H2O C 5.6-6.9 313.76
【解析】(1)将原料粉碎可增大固体接触面积,加快酸浸的速率;(2)由图像可知,在70℃时,反应到120min镍浸出率较高;(3)根据流程中信息可知,镍与浓硝酸反应可生成Ni2+,浓硝酸被还原生成NO2,故反应方程式为:Ni+4HNO3(浓)=Ni(NO3)2+2NO2↑+2H2O;(4)加入试剂X需中和溶液中过量的硝酸,并调节溶液的pH至5.6-6.9范围,让溶液中的Fe3+、Cr3+转化为Fe(OH)3、Cr(OH)3沉淀,故试剂X可用NaOH,答案选C;(5)要让1L c(Ni2+)=2.0 mol· L-1的溶液中Ni2+完全反应需n(CO32-)=CV=2.0 mol· L-1×1L=2mol。要使溶液中c(Ni2+)≤10-5mol·L-1,需c(CO32-)=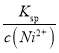 =
=![]() =0.96 mol·L-1。故加入的碳酸钠的总物质的量为2mol+0.96mol=2.96mol,其质量为2.96mol ×106g/mol=313.76g。
=0.96 mol·L-1。故加入的碳酸钠的总物质的量为2mol+0.96mol=2.96mol,其质量为2.96mol ×106g/mol=313.76g。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
A.滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失
B.锥形瓶用蒸馏水洗净后,未经干燥即进行滴定
C.滴定过程中,锥形瓶中有溶液溅出
D.酸式滴定管未用标准盐酸润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.SO2和CO2都能使澄清石灰水变浑浊
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硫酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( ) 
A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
B.在镀件上电镀锌,用锌作阳极
C.用如图1装置生产家用消毒液(NaClO)
D.用如图2装置为铅蓄电池充
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
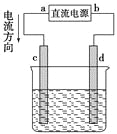
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.KMnO4 是一种氧化剂,实验室常用 KMnO4和浓盐酸反应制备 Cl2。下图是制备 NaClO溶液的装置图。
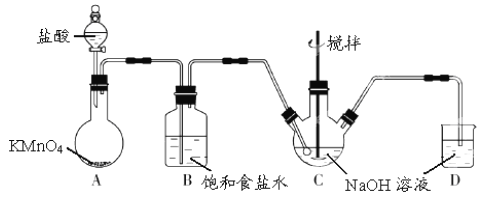
完成下列填空:
(1)KMnO4 稀溶液是一种常见消毒剂,其消毒机理与以下物质相似的是______(选填编号)。
a.75%酒精 b.双氧水 c.NaClO 溶液 d.硫磺皂
(2)B装置中饱和食盐水的作用是___________,D装置中NaOH的作用是______________。
(3)实验操作过程中可调节__________以控制A 装置中产生 Cl2 的气流,C装置需控制反应温度在 0~5℃,实验中可将C 装置放入________________中。
II.测定 KMnO4纯度可用标准 Na2S2O3(式量—158)溶液进行滴定,反应离子方程式为:8MnO4-+5S2O32-+14H+→10SO42-+8Mn2++7H2O。
(4)配制250 mL 0.1000 mol/L标准 Na2S2O3溶液,需准确称取Na2S2O3固体的质量为____g。
(5)取某 KMnO4(式量-158) 产品 0.600g,酸化后用 0.1000 mol/L 标准 Na2S2O3溶液进行滴定,滴定至终点消耗 Na2S2O3溶液 20.00 mL,则该 KMnO4 产品的纯度是_________(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
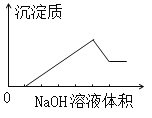
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与等质量且少量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A.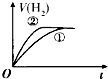
B.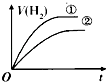
C.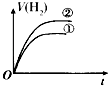
D.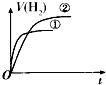
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com