
| (i)B2H6 |
| (ii)H2O2/OH- |
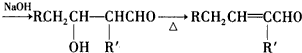
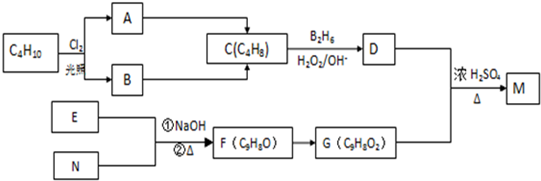
 ,则F为
,则F为 ,由F与G的分子式可知,F中醛基发生氧化反应生成羧基,则G为
,由F与G的分子式可知,F中醛基发生氧化反应生成羧基,则G为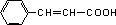 ,D与G发生酯化反应生成M为
,D与G发生酯化反应生成M为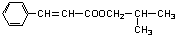 ,据此解答.
,据此解答.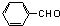 ,则F为
,则F为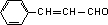 ,由F与G的分子式可知,F中醛基发生氧化反应生成羧基,则G为
,由F与G的分子式可知,F中醛基发生氧化反应生成羧基,则G为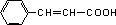 ,D与G发生酯化反应生成M为
,D与G发生酯化反应生成M为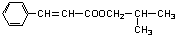 ,
,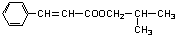 ,故答案为:
,故答案为: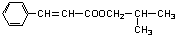 ;
;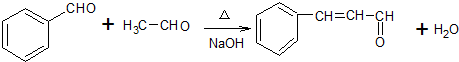 ,
, ;
;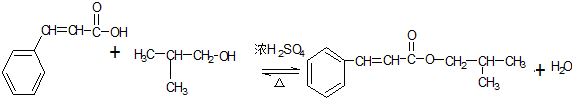 ,
, ;
;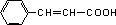 )具有相同官能团的G的所有芳香类同分异构体的结构简式:
)具有相同官能团的G的所有芳香类同分异构体的结构简式: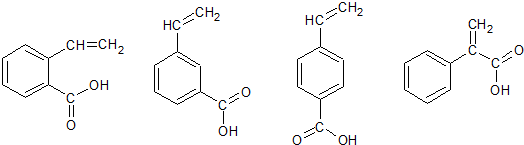 ,
, .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、盐酸和食醋既是化合物又是酸 |
| B、凡是生成两种或两种以上物质的反应都是分解反应 |
| C、氯化钠和HCl溶于水都发生电离,克服粒子间作用力相同 |
| D、一种元素可能有多种氧化物,且一种化合价可能对应不止一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
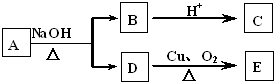
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
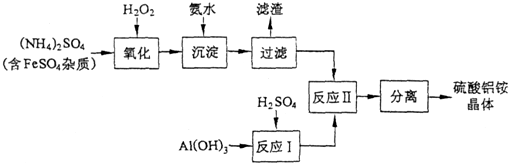
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,且一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来用力振荡 |
| B、静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通,以准备放出液体 |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 |
| D、上层液体在分液漏斗中保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
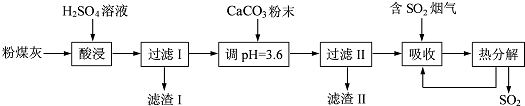
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com