
【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。
【答案】H2SO4=HSO![]() +H+、HSO
+H+、HSO![]()
![]() H++SO
H++SO![]() c(Na+)>c(SO
c(Na+)>c(SO![]() )>c(OH–)>c(HSO
)>c(OH–)>c(HSO![]() )>c(H+) 1.77×10-5或1.8×10–5
)>c(H+) 1.77×10-5或1.8×10–5 ![]() 或(b-0.01)×10-5
或(b-0.01)×10-5
【解析】
本题是对于电解质溶液中电离平衡的考查,考点涉及弱电解质的电离、电离平衡常数计算以及溶液中离子浓度大小比较,根据题意知H2SO4的电离是分步的,根据电离程度书写电离方程式,混合溶液中离子浓度大小比较需考虑反应情况和水解情况,平衡常数的计算利用题目给出的电离度、pH进行计算。
(1)已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全,所以硫酸在水中的电离方程式为H2SO4=HSO4–+H+ 、 HSO4–![]() H++ SO42–;
H++ SO42–;
(2)将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成硫酸钠,但由于SO42-水解SO42-+H2O![]() HSO4-+OH-,因此溶液显碱性,又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+);
HSO4-+OH-,因此溶液显碱性,又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+);
(3)醋酸的电离度是1.33%,则
CH3COOH![]() CH3COO- + H+
CH3COO- + H+
起始浓度(mol/L) 0.1 0 0
转化浓度(mol/L) 0.1×1.33% 0.1×1.33% 0.1×1.33%
平衡浓度(mol/L)0.1-0.00133 0.00133 0.00133
该温度下醋酸的电离常数Ka=![]() =
=![]() =1.77×10–5;反应达平衡时,测得溶液的pH=7,则根据电荷守恒可知c(CH3COO-)+c(Cl-)+c(OH–)=c(Na+)+c(H+),因此c(OH–)=c(H+)=10-7mol/L、c(CH3COO-)+c(Cl-)=c(Na+)=0.5bmol/L,所以c(CH3COO-)=c(Na+)-c(Cl-)=0.5bmol/L-0.005mol/L。根据物料守恒可知溶液醋酸的浓度是0.5bmol/L-(0.5bmol/L-0.005mol/L)=0.005mol/L,所以该温度下醋酸的电离常数=
=1.77×10–5;反应达平衡时,测得溶液的pH=7,则根据电荷守恒可知c(CH3COO-)+c(Cl-)+c(OH–)=c(Na+)+c(H+),因此c(OH–)=c(H+)=10-7mol/L、c(CH3COO-)+c(Cl-)=c(Na+)=0.5bmol/L,所以c(CH3COO-)=c(Na+)-c(Cl-)=0.5bmol/L-0.005mol/L。根据物料守恒可知溶液醋酸的浓度是0.5bmol/L-(0.5bmol/L-0.005mol/L)=0.005mol/L,所以该温度下醋酸的电离常数=![]() =
=![]() =(b-0.01)×10-5。
=(b-0.01)×10-5。


科目:高中化学 来源: 题型:
【题目】氢化阿托醛![]() 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
(1)氢化阿托醛被催化氧化后的含氧官能团的名称是____________.
(2)在合成路线上②③的反应类型分别为②_____________③________________.
(3)反应④发生的条件是_____________________.
(4)由![]() 反应的化学方程式为_______________________________
反应的化学方程式为_______________________________
(5)1mol氢化阿托醛最多可和____mol氢气加成,1mol氢化阿托醛发生银镜反应可生成________molAg.
(6)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为________.D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有______种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2二溴乙烷的制备原理是:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
CH2=CH2+H2O CH2=CH2+Br2→ Br2CH2一CH2Br
某课题小组用下图所示的装置制备1,2-二溴乙烷。

回答下列问题
(1)组装仪器后进行该实验前必须进行的操作是_________。
(2)装置B的作用是_______。
(3)三颈烧瓶内加入一定量的乙醇一浓硫酸混合液和少量粗砂,其加入粗砂目的是_______,仪器E的名称是_________________。
(4)装置C内发生的主要反应的离子方程式为__________________________。
(5)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A内反应温度升温至160-180℃,从滴液漏斗中慢慢滴加乙醇一浓硫酸混合液,保持乙烯气体均匀地通入装有3.20ml液溴(![]() 3g/cm3)和3ml水的D中试管,直至反应结束。
3g/cm3)和3ml水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_____________________,
②判断反应结束的现象是______________________________。
(6)将粗品移入分液漏斗,分别用水、氢氧化钠溶液、水洗涤,产品用无水氯化钙干燥,过滤后蒸馏收集129-133℃馏分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的产率为___________。
(7)下列操作中,不会导致产物产率降低的是________ (填正确答案的标号)
a.乙烯通入溴水时速率太快 b.装置E中的NaOH溶液用水代替.
c.去掉装置D烧杯中的水 d.实验时没有C装置 e. D中的试管里不加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
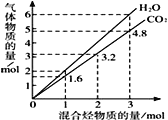
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
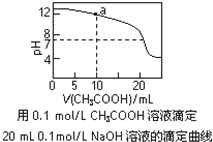
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH![]() CH4↑+Na2CO3,
CH4↑+Na2CO3,
为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:__。
(2)C装置中的试剂为__,作用是__。
(3)实验测得消耗的CH4和CuO的质量比为1:20,则D中硬质玻璃管内发生反应的化学方程式为__。
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:①试管中有少量白雾;②导管内液面上升;③__;④___。
(5)有关该实验的说法,正确的是__(填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B装置中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
D.G装置的大试管取下黑色纸套后,光照强度越大,CH4与Cl2越易发生取代反应
(6)实验室还可用碳化铝(Al4C3)固体与H2O反应制备甲烷,写出反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是:
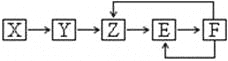
A. X可能是一种氢化物
B. 若Y为单质,Y生成Z属于化合反应
C. E可能是一种有色气体
D. F中M元素的化合价可能为+5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com