
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
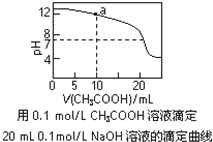
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
【答案】C
【解析】
A.pH相同的钠盐溶液中,弱根离子水解程度越大,其盐溶液浓度越小,碳酸钠的水解程度大于碳酸氢钠,大于醋酸钠,则当三种溶液的pH相同时,其物质的量浓度由大到小的顺序是③<②<①,钠离子浓度大小顺序是③<②<①,故A错误;
B.根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A),故B错误;
C.a点溶液中存在的溶质是等物质的量的醋酸钠和氢氧化钠,根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故C正确;
D.pH=7时c(OH-)=c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)=c(CH3COO-),故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是( )
A.![]() 和
和![]() 不属于同分异构体
不属于同分异构体
B.质量相同的![]() 和
和![]() 完全燃烧时消耗氧气的质量较少的是
完全燃烧时消耗氧气的质量较少的是![]()
C.连接四个不同基团的碳原子为“手性碳原子”,![]() 含有两个手性碳原子
含有两个手性碳原子
D.标准状况下![]() L溴乙烷所含化学键总数为
L溴乙烷所含化学键总数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
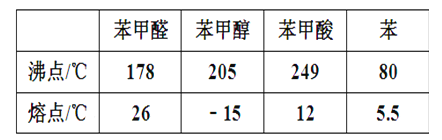
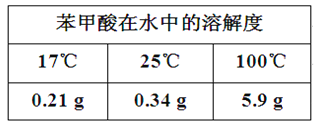
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。有关物质物理性质如表:
实验流程如下:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因__。
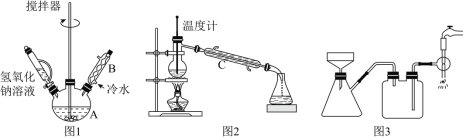
(2)操作中有关分液漏斗的使用不正确的是__。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集_℃的馏分。图2中有一处明显错误,正确的应改为__。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,__冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000molL-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,则苯甲酸样品的纯度为__%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法不正确的是

A.每产生1molO2,整个电解池中理论上转移电子数为4NA
B.阴极电极反应式为2H2O + 2e- = H2↑+2OH—
C.若铁为阳极,则阳极电极方程式为Fe-2e-=Fe2+和2H2O - 4e- = O2↑+4H+
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风—41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属Al—Cu—Mg—Zn系。Cu在元素周期表中的位置是___,比较第一电离能Mg___Al(填“>”“<”“=”)。
(2)金属Zn中的原子采取___最密堆积。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___。钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为___。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为___,S的___杂化轨道与O的2p轨道形成___键(填“π”或“σ”)。
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于___晶体,CO与Fe之间的化学键称为___。与CO互为等电子体的分子或离子是___(只写一种)。
(6)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为apm,则晶胞的密度为___g/cm3(用含a、NA的计算式表示)。
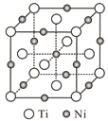
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转。
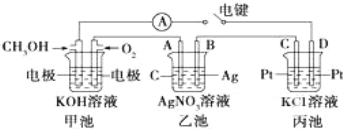
请回答下列问题:
(1)通入 CH3OH 电极的电极反应:___________________。
(2)乙池中 A(石墨)电极的名称为_________________(填“正极”、“负极”或“阴极”、“阳极”),总化学反应式为___________________。
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_______mL(标准状况)。若丙池中KCl溶液的体积是500mL,电解后,溶液的pH为_________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚 ,可以烃用 A 通过下列路线制得:
是一种有机烯醚 ,可以烃用 A 通过下列路线制得:
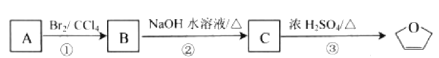
则下列说法正确的是
A.![]() 分子式为C4H4O
分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.![]() 分子中所有原子可能共面
分子中所有原子可能共面
D.①②③的反应类型分别为加成、水解、取代
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com