
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转。
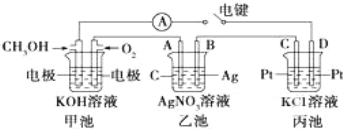
请回答下列问题:
(1)通入 CH3OH 电极的电极反应:___________________。
(2)乙池中 A(石墨)电极的名称为_________________(填“正极”、“负极”或“阴极”、“阳极”),总化学反应式为___________________。
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_______mL(标准状况)。若丙池中KCl溶液的体积是500mL,电解后,溶液的pH为_________(设电解前后溶液体积无变化)。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O 阳极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 13
4Ag+O2↑+4HNO3 280 13
【解析】
(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;
(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气;
(3)乙池是电解池结合电子守恒计算消耗氧气的体积,丙为电解池C为阳极,D为阴极,电解氯化钾溶液,生成氢氧化钾、氢气和氯气;
(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 ;
4Ag+O2↑+4HNO3 ;
(3)当乙池中B极质量增加5.4g为Ag,物质的量=5.4g÷108g·mol-1=0.05mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=![]() mol×22.4L·mol-1=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化钾溶液,生成氢氧化钾、氢气和氯气,结合电子守恒计算KOH~e-,n(KOH)=0.05mol,c(KOH)=0.05mol÷0.5L=0.1mol·L-1,pH= -lg
mol×22.4L·mol-1=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化钾溶液,生成氢氧化钾、氢气和氯气,结合电子守恒计算KOH~e-,n(KOH)=0.05mol,c(KOH)=0.05mol÷0.5L=0.1mol·L-1,pH= -lg![]() =13。
=13。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为①SO2+2Fe3++2H2O→![]() +2Fe2++W,②
+2Fe2++W,②![]() +aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
+aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
A.还原性:Cr3+>SO2B.方程式②中,a=6,b=7
C.![]() 能将Na2SO3氧化成Na2SO4D.方程式①中W为OH
能将Na2SO3氧化成Na2SO4D.方程式①中W为OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
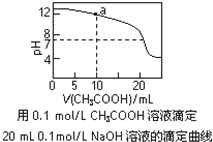
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH![]() CH4↑+Na2CO3,
CH4↑+Na2CO3,
为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:__。
(2)C装置中的试剂为__,作用是__。
(3)实验测得消耗的CH4和CuO的质量比为1:20,则D中硬质玻璃管内发生反应的化学方程式为__。
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:①试管中有少量白雾;②导管内液面上升;③__;④___。
(5)有关该实验的说法,正确的是__(填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B装置中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
D.G装置的大试管取下黑色纸套后,光照强度越大,CH4与Cl2越易发生取代反应
(6)实验室还可用碳化铝(Al4C3)固体与H2O反应制备甲烷,写出反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的原子序数依次增加,A、B、C、D、E是由这些元素组成的二元化合物,F是元素W的单质。B为一种常见的五核有机物,D常温下呈液态,C、E均能与人体血红蛋白结合使人中毒,上述物质的转化关系如图所示。下列说法正确的

A.原子半径的大小![]()
B.元素Z的氢化物的熔沸点一定比Y的高
C.一定条件下,E和C、D均能发生化学反应
D.Y的最高价氧化物对应的水化物酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
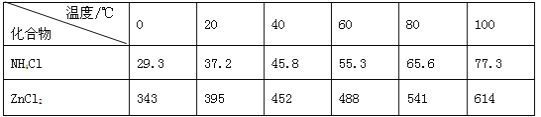
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为常见的金属单质,根据下图所示的关系:
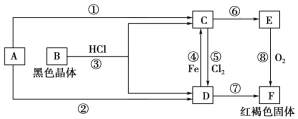
下列叙述中不正确的是
A. A为Fe,B为Fe3O4
B. C→D溶液的颜色变化:由浅绿色到黄色
C. ④的离子方程式:Fe+Fe3+===2Fe2+
D. ⑧的化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.金刚石中C—C键的键长为154.45 pm, C60中C—C键的键长为 140~ 145 pm,所以C60的熔点高于金刚石
B.CO2晶体是分子晶体,SiO2晶体也是分子晶体
C.从CH4 、![]() 、
、![]() 为正面体结构,可推测CC14、
为正面体结构,可推测CC14、![]() 、
、![]() 也为正四面体结构
也为正四面体结构
D.H2O常温下为液态,H2S常温下也为液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com