
【题目】实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH![]() CH4↑+Na2CO3,
CH4↑+Na2CO3,
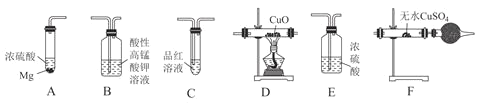
为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:__。
(2)C装置中的试剂为__,作用是__。
(3)实验测得消耗的CH4和CuO的质量比为1:20,则D中硬质玻璃管内发生反应的化学方程式为__。
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:①试管中有少量白雾;②导管内液面上升;③__;④___。
(5)有关该实验的说法,正确的是__(填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B装置中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
D.G装置的大试管取下黑色纸套后,光照强度越大,CH4与Cl2越易发生取代反应
(6)实验室还可用碳化铝(Al4C3)固体与H2O反应制备甲烷,写出反应的化学方程式:__。
【答案】2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O或ClO-+Cl-+2H+=Cl2↑+H2O 浓硫酸 干燥甲烷 CH4+4CuO![]() 4Cu+CO2+2H2O 试管内气体颜色逐渐变浅 试管内壁有油状液滴出现 B Al4C3+12H2O=4Al(OH)3+3CH4↑
4Cu+CO2+2H2O 试管内气体颜色逐渐变浅 试管内壁有油状液滴出现 B Al4C3+12H2O=4Al(OH)3+3CH4↑
【解析】
A中进行反应制取CH4,B中溴水或KMnO4,进行CH4的性质实验;D中CH4与CuO反应充分被氧化,生成CO2和H2O;无水硫酸铜,用于检验水,为了防止通过B装置时,引入H2O的杂质会影响实验,因此C为干燥装置,装有浓硫酸;澄清石灰石用于检验CO2,在G中的大试管中进行,CH4和Cl2的取代反应的实验。
(1)装置H是一个固体和液体不加热反应制氯气的装置,故可以选用酸性高锰酸钾、重铬酸钾、次氯酸钙等和浓盐酸反应,离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O或ClO-+Cl-+2H+=Cl2↑+H2O等。
(2)D中盛放的是氧化铜,所以C装置的作用是干燥甲烷,由于是洗气瓶,只能选用浓硫酸;
(3)实验消耗甲烷和氧化铜质量比为![]() ,即物质的量比为
,即物质的量比为![]() ,根据原子守恒可得化学方程式为CH4+4CuO
,根据原子守恒可得化学方程式为CH4+4CuO![]() 4Cu+CO2+2H2O;
4Cu+CO2+2H2O;
(4)在自然光照射下,甲烷能与氯气反应,生成HCl、![]() 、
、![]() 、
、![]() 、
、![]() ,由于HCl极易溶于水,故可看到导管内液面上升,试管口产生白雾,试管内气体颜色逐渐变浅,试管内壁有油状液滴出现等现象;
,由于HCl极易溶于水,故可看到导管内液面上升,试管口产生白雾,试管内气体颜色逐渐变浅,试管内壁有油状液滴出现等现象;
(5)A项,甲烷和溴水不反应,但是甲烷和氯气、溴蒸气等在光照条件下可发生取代反应,错误;
B项,甲烷性质稳定,与强酸、强碱、强氧化剂一般都不能反应,正确;
C项,玻璃管中固体粉末由黑变红,说明氧化铜被还原,体现了甲烷的还原性,错误;
D项,光线太强,反应剧烈可能会产生爆炸等安全事故,错误;
综上B正确;
(6)依题意,碳化铝和水反应生成氢氧化铝和甲烷,因此可写出对应方程式为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组探究足量的镁与浓硫酸反应。回答下列问题:
Ⅰ.甲同学设计如图实验验证该过程产生的混合气体中含有![]() 、
、![]() 。
。
![]() 若按气体从左到右的流向,各装置的连接顺序是________
若按气体从左到右的流向,各装置的连接顺序是________![]() 填字母编号
填字母编号![]() 。
。
![]() 已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
![]() 装置C的作用是________。
装置C的作用是________。
![]() 证明混合气体中含有H2的实验现象为________。
证明混合气体中含有H2的实验现象为________。
Ⅱ.乙同学设计如图实验测定混合气体中SO2的含量。

![]() 溶液可以是________
溶液可以是________![]() 填字母
填字母![]() 。
。
![]() 溶液
溶液
![]() 酸性
酸性![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]()
![]() 溴水
溴水
![]() 步骤
步骤![]() 中洗涤沉淀的操作为________。
中洗涤沉淀的操作为________。
![]() 通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量
通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量![]() 体积分数
体积分数![]() 为________
为________![]() 用含V、m的代数式表示
用含V、m的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。有关物质物理性质如表:
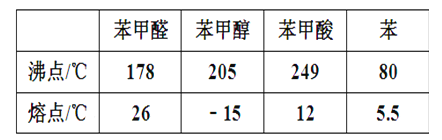
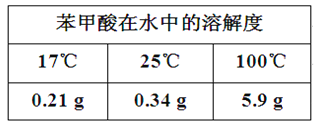
实验流程如下:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因__。
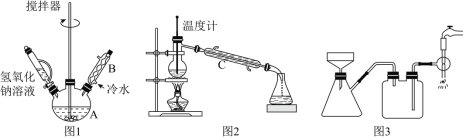
(2)操作中有关分液漏斗的使用不正确的是__。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集_℃的馏分。图2中有一处明显错误,正确的应改为__。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,__冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000molL-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,则苯甲酸样品的纯度为__%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风—41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属Al—Cu—Mg—Zn系。Cu在元素周期表中的位置是___,比较第一电离能Mg___Al(填“>”“<”“=”)。
(2)金属Zn中的原子采取___最密堆积。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___。钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为___。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为___,S的___杂化轨道与O的2p轨道形成___键(填“π”或“σ”)。
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于___晶体,CO与Fe之间的化学键称为___。与CO互为等电子体的分子或离子是___(只写一种)。
(6)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为apm,则晶胞的密度为___g/cm3(用含a、NA的计算式表示)。
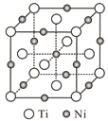
查看答案和解析>>
科目:高中化学 来源: 题型:
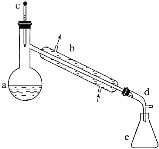
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
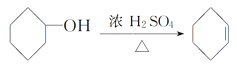 +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转。
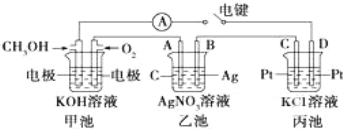
请回答下列问题:
(1)通入 CH3OH 电极的电极反应:___________________。
(2)乙池中 A(石墨)电极的名称为_________________(填“正极”、“负极”或“阴极”、“阳极”),总化学反应式为___________________。
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_______mL(标准状况)。若丙池中KCl溶液的体积是500mL,电解后,溶液的pH为_________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶休,结构如图所示,有关说法不正确的是
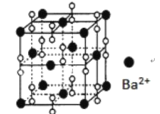
A.该晶体属于离子晶体
B.该晶体晶胞结构与NaCl相似
C.晶体的化学式为Ba2O2
D.与每个Ba2+距离相等且最近的 Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由相同金属电极及其不同浓度的盐溶液组成的电池称为浓差电池,电子由溶液浓度较小的一极流向浓度较大的一极。如图所示装置中,X电极与Y电极初始质量相等。 进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流计指针偏转。下列不正确的是

A.充电前,该电池两电极不存在电势差
B.放电时,右池中的NO3-通过离了交换膜移向左池
C.充电时,当外电路通过0.1 mol电子时,两电极的质量差为10.8 g
D.放电时,电极Y为电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com