
【题目】在建国70周年阅兵仪式上,“歼20”“东风—41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属Al—Cu—Mg—Zn系。Cu在元素周期表中的位置是___,比较第一电离能Mg___Al(填“>”“<”“=”)。
(2)金属Zn中的原子采取___最密堆积。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___。钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为___。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为___,S的___杂化轨道与O的2p轨道形成___键(填“π”或“σ”)。
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于___晶体,CO与Fe之间的化学键称为___。与CO互为等电子体的分子或离子是___(只写一种)。
(6)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为apm,则晶胞的密度为___g/cm3(用含a、NA的计算式表示)。
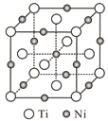
【答案】第四周期IB族 > 六方 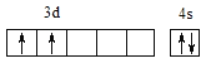 8 正四面体 sp3 σ 分子 配位键 N2或CN-
8 正四面体 sp3 σ 分子 配位键 N2或CN- ![]()
【解析】
根据元素的价电子排布得出价电子排布图,并判断元素位置,结合原子半径分析第一电离能大小;根据杂化轨道互斥理论判断粒子空间构型;根据等电子体的概念书写与CO互为等电子体的分子或离子,利用均摊法和相关公式进行晶胞密度的计算。
(1)Cu为29号元素,价电子3d104s1,在元素周期表中的位置是第四周期IB族,同周期,第一电离能从左到右呈增大趋势,但第IIA族的s轨道为全充满状态,因此第一电离能Mg>Al;故答案为:第四周期IB族;>;
(2)金属锌中的Zn原子的配位数为12,采用六方最密堆积,故答案为:六方;
(3)Ti为22号元素,其价电子排布式为3d24s2,则价电子排布图为 ,钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为8;故答案为:
,钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为8;故答案为: ;8;
;8;
(4)Ti(SO4)2、NiSO4其中阴离子的价层电子对数为![]() ,其立体构型为正四面体形,S是sp3杂化,杂化轨道都是形成σ键,因此S的sp3杂化轨道与O的2p轨道形成σ键;故答案为:正四面体;sp3;σ;
,其立体构型为正四面体形,S是sp3杂化,杂化轨道都是形成σ键,因此S的sp3杂化轨道与O的2p轨道形成σ键;故答案为:正四面体;sp3;σ;
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,说明熔点低,固体羰基铁属于分子晶体,CO与Fe之间的形成的化学键称为配位键,因为价电子C和N+相同,N和O+相同,所以与CO互为等电子体的分子或离子是N2或CN-;故答案为:分子;配位键;N2或CN-;
(6)根据钛镍合金的立方晶胞结构得到Ti的个数为![]() ,Ni的个数为
,Ni的个数为![]() ,若晶胞的边长为apm,则晶胞的密度为
,若晶胞的边长为apm,则晶胞的密度为 ;故答案为:
;故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式____________________________
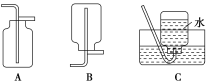
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
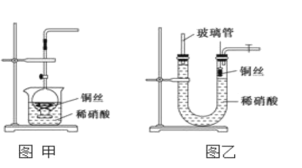
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________________________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是________________________________。
②让反应停止的操作方法及原因是_________________。
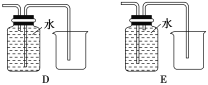
(4)以下收集NO气体装置,不合理的是____(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2—二溴乙烷是一种无色液体,有挥发性,有毒,难溶于水,沸点为132℃,密度为2.2gmL-1。某研究性学习小组的同学利用如图(加热装置省略)装置制备一定量的1,2—二溴乙烷,制备原理为:C2H5OH→C2H4→CH2BrCH2Br。Y中的浓硫酸是催化剂、脱水剂,乙醇的密度为0.8gmL-1。
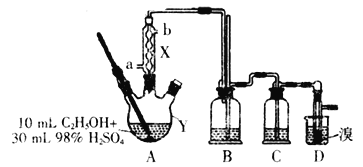
(1)仪器Y的名称是__,由乙醇制备乙烯需要控制温度在170℃,使用X的目的是__,实验中加热A与向X中通入冷却剂的顺序是__。
(2)实验时Y中液体会变成黑色,并有刺激性气味的无机气体产生,变成黑色的原因是__,为吸收反应中生成的无机气体,在装置C中应加入__。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)写出D中反应的化学方程式:__;若产物中有少量未反应的Br2,最好用___洗涤除去。
a.水 b.Na2CO3溶液 c.碘化钠溶液 d.乙醇
(4)该套装置存在一个明显的不足,不足之处是__。
(5)若得到ag1,2—二溴乙烷,所用乙醇的利用率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
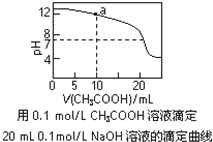
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L c(HA)+c(A-)=0.1mol/L的溶液中滴加盐酸或NaOH溶液,溶液中的H+、OH-、A-及HA的浓度的对数值(lgc)与pH的关系如图所示(不考虑溶液温度变化),下列说法正确的是
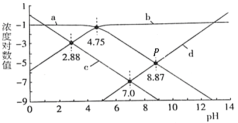
A.a表示lgc(A-)与pH的关系曲线
B.K(HA)的数量级为10-5
C.P点溶液中n(Na+)+ n(H+)=0.1mol
D.滴加盐酸或NaOH溶液的过程中c(HA)·c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH![]() CH4↑+Na2CO3,
CH4↑+Na2CO3,
为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:__。
(2)C装置中的试剂为__,作用是__。
(3)实验测得消耗的CH4和CuO的质量比为1:20,则D中硬质玻璃管内发生反应的化学方程式为__。
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:①试管中有少量白雾;②导管内液面上升;③__;④___。
(5)有关该实验的说法,正确的是__(填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B装置中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
D.G装置的大试管取下黑色纸套后,光照强度越大,CH4与Cl2越易发生取代反应
(6)实验室还可用碳化铝(Al4C3)固体与H2O反应制备甲烷,写出反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的原子序数依次增加,A、B、C、D、E是由这些元素组成的二元化合物,F是元素W的单质。B为一种常见的五核有机物,D常温下呈液态,C、E均能与人体血红蛋白结合使人中毒,上述物质的转化关系如图所示。下列说法正确的

A.原子半径的大小![]()
B.元素Z的氢化物的熔沸点一定比Y的高
C.一定条件下,E和C、D均能发生化学反应
D.Y的最高价氧化物对应的水化物酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为常见的金属单质,根据下图所示的关系:
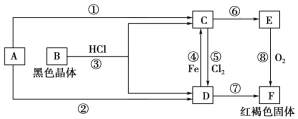
下列叙述中不正确的是
A. A为Fe,B为Fe3O4
B. C→D溶液的颜色变化:由浅绿色到黄色
C. ④的离子方程式:Fe+Fe3+===2Fe2+
D. ⑧的化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
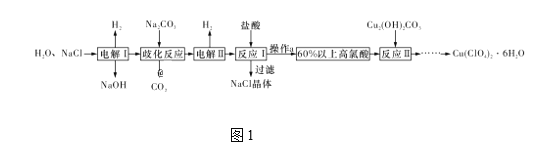
(1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________。
(3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。
(4)操作a的名称是____。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com