
【题目】在室温下,下列四种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.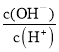 E.
E.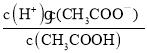
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
【答案】酸 NH4+ + H2O![]() NH3·H2O + H+ = BD 10 : 1
NH3·H2O + H+ = BD 10 : 1
【解析】
(1)NH4Cl是强酸弱碱盐;
(2)根据电荷守恒,CH3COONH4溶液中c(CH3COO-) + c(OH-) =c(NH4+)+ c(H+);
(3)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,醋酸的电离平衡正向移动,电离程度增大,电离平衡常数不变。
(4)根据c(OH-)×V(碱)=c(H+)×V(酸)计算。
(1)NH4Cl是强酸弱碱盐,NH4+发生水解反应NH4+ + H2O![]() NH3·H2O + H+,所以溶液呈酸性;
NH3·H2O + H+,所以溶液呈酸性;
(2)根据电荷守恒,CH3COONH4溶液中c(CH3COO-) + c(OH-) =c(NH4+)+ c(H+),溶液呈中性c(OH-) = c(H+),所以c(CH3COO-)=c(NH4+);
(3)A.醋酸加水稀释c(H+)减小; B.醋酸加水稀释,电离平衡正向移动, n(H+)增大、n(CH3COOH)减小,所以 增大 ; C.加水稀释,温度不变,水的离子积常数不变,所以c(H+)·c(OH-)不变; D.温度不变,水的离子积常数不变,加水稀释,醋酸加水稀释c(H+)减小,所以c(OH-)增大,
增大 ; C.加水稀释,温度不变,水的离子积常数不变,所以c(H+)·c(OH-)不变; D.温度不变,水的离子积常数不变,加水稀释,醋酸加水稀释c(H+)减小,所以c(OH-)增大,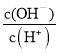 增大; E.温度不变,加水稀释,电离平衡常数不变,所以
增大; E.温度不变,加水稀释,电离平衡常数不变,所以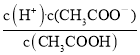 不变。故选BD;
不变。故选BD;
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则c(OH-)×V(碱)=c(H+)×V(酸),
![]() ,
,![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取。请回答下列问题:
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
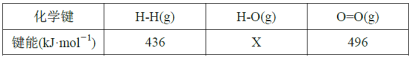
①由此计算x=___,通过比较ΔH1和ΔH2,说明氧化裂解法中通入氧气的作用是___。
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1___P2(填“>”、“<”或“=”)。
③请求出下列反应的反应热:C2H6(g)+![]() O2(g)=C2H4(g)+H2O(l) ΔH3=___。
O2(g)=C2H4(g)+H2O(l) ΔH3=___。
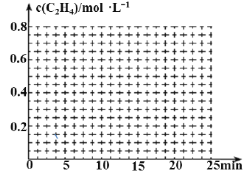
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=___。
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:____。
(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
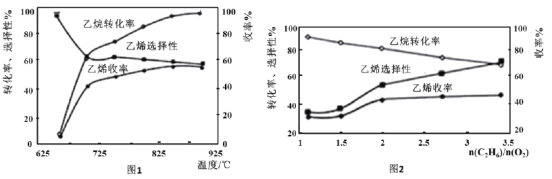
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___;判断的理由是___。
的最佳值是___;判断的理由是___。
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
(6)反应达平衡时,各组分的体积分数如下表:
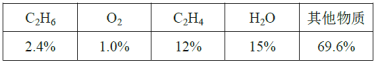
计算该温度下的平衡常数Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3)
B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2-3△H3)
D. △H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10L0.1mol·L-1氨水与10L0.1mol·L-1盐酸混合:[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用勒夏特列原理解释的是( )
A.对于CO(g)+NO2(g)![]() CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
B.氢气和氮气合成氨的反应中,在加压下有利于氨的生成
C.开启可乐瓶,瓶中马上泛起大量气泡
D.利用排液法收集氯气时常用液体为饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 质子膜燃料电池工作原理如图。下列说法不正确的是
质子膜燃料电池工作原理如图。下列说法不正确的是![]()

A.电池工作时,电流从电极b经过负载流向电极a
B.电极a上发生的电极反应式为![]()
C.电路中通过4mol电子时,4mol![]() 经质子膜进入正极区
经质子膜进入正极区
D.当反应生成64![]() 时,电池内部释放632kJ热量
时,电池内部释放632kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )
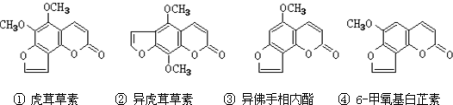
A.②中所含官能团种类比③中多
B.①、④互为同系物
C.①、②、③、④均能使溴水褪色
D.等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:

该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述错误的是

A.b极发生还原反应
B.a极的反应式为N2H4 - 4e-=N2↑+4H+
C.放电时,电流从b极经过负载流向a极
D.其中的离子交换膜需选用阴离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com