
【题目】某含铬(Cr2O![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到n mol FeO·FeyCrxO3,不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中Cr2O![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子总物质的量为3nxmol
D. 在FeO·FeyCrxO3中,3x=y
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于碱金属的叙述中,正确的是
A. 金属钠着火时,可用水或泡沫灭火器灭火
B. 碱金属单质都可保存在煤油中
C. 钠离子核外电子数比钠原子核外电子数少
D. 碱金属中密度最小、熔沸点最高的是铯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与16g氧气所含原子总数相同的氨气是_____________g;在相同条件下,在5.6g氮气中应添加___________g氨气所组成的混合气体与16g氧气所占的体积相等。
(2)把__________g NaOH溶解在90g水中,才能使得每10个水分子中有1个Na+。
(3)质量之比为16∶7∶6的三种气体SO2、CO、NO,氧原子个数之比为________。
(4)某气体氧化物的化学式为RO2,在标准状况下,0.92g该氧化物的体积为448mL,则该氧化物的摩尔质量为________。
(5)8.5g氢氧根离子含有的电子数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84 g/mL)配制1 mol·L-1的稀H2SO4100mL,配制过程中可能用到下列仪器:
①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。按使用出现的先后顺序排列正确的是
A. ②⑥③⑦⑤ B. ④③⑤⑦⑥ C. ①③⑦⑤⑥ D. ②⑤⑦⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是
A. 蒸馏 B. 萃取 C. 升华 D. 结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美、英研究人员相继宣布“去除排斥基因”的猪已经降生。人们可以利用这种猪大量“生产”适用于移植手术的器官。在此之前如果把猪器官移植给人体,人体的免疫系统能识别猪细胞上的X物质,从而发生强烈的排异反应,X物质所处的位置和化学成分分别是( )
A. 细胞膜类脂 B. 细胞膜糖与蛋白质的复合物
C. 细胞核脱氧核糖核酸 D. 细胞质蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
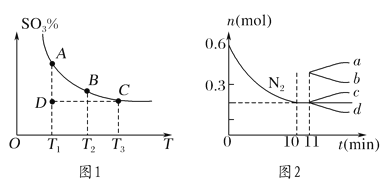
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com