
【题目】已知2X2(g)+Y2(g)![]() 2Z(g) ΔH1=-akJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和lmolY2,在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。
2Z(g) ΔH1=-akJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和lmolY2,在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。
(1)此反应平衡常数表达式为___;若将温度降低到300℃,则反应平衡常数将___(填增大、减少或不变)。
(2)能说明反应己达平衡状态的是___
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(3)若将上述容器改为恒压容器![]() 反应器开始体积相同
反应器开始体积相同![]() ,相同温度下起始加入2molX2和lmolY2达到平衡后,Y2的转化率将____(填变大、变小或不变)。
,相同温度下起始加入2molX2和lmolY2达到平衡后,Y2的转化率将____(填变大、变小或不变)。
【答案】K=![]() 增大 BC 变大
增大 BC 变大
【解析】
(1)根据化学平衡常数概念可得K的表达式,根据温度对化学平衡的影响分析判断;
(2)根据化学平衡时正逆反应速率相等,各组分的含量保持不变进行判断;
(3)原平衡随反应进行,压强降低,恒压容器(反应器开始体积相同),相同温度下起始加入2molX2和1molY2,等效为在原平衡的基础上增大压强,平衡向气体体积减小的方向移动,据此判断。
(1)2X2(g)+Y2(g)2Z(g),化学平衡常数K=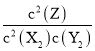 ;△H=-akJmol-1,a>0,则△H<0,正反应为放热反应,降低温度,平衡向着正反应方向移动,K增大,故答案为:K=
;△H=-akJmol-1,a>0,则△H<0,正反应为放热反应,降低温度,平衡向着正反应方向移动,K增大,故答案为:K=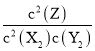 ;增大;
;增大;
(2)A.平衡时浓度不变,不一定满足c(Z)=2c(Y2),故A错误;B.该反应是个气体体积减小的反应,随着反应的进行,压强减小,当容器内压强保持不变时,说明反应达到平衡状态,故B正确;C.v逆(X2)=2v正(Y2)=v正(X2),正逆反应速率相等,反应达到平衡状态,故C正确;D.恒容气体体积不变,混合气体的质量不变,根据ρ=![]() ,容器内的密度始终不变,不能说明是平衡状态,故D错误;故答案为:BC;
,容器内的密度始终不变,不能说明是平衡状态,故D错误;故答案为:BC;
(3)原平衡随反应进行,压强降低.恒压容器(反应器开始体积相同),相同温度下起始加入2molX2和1molY2,等效为在原平衡的基础上增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,Y2的转化率变大,故答案为:变大。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机反应类型的认识中,不正确的是( )
A.![]() +HNO3
+HNO3![]()
![]() +H2O;取代反应
+H2O;取代反应
B.CH4+Cl2 ![]() CH3Cl + HCl ;置换反应
CH3Cl + HCl ;置换反应
C.CH2=CH2+H2O![]() CH3—CH2OH;加成反应
CH3—CH2OH;加成反应
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;酯化反应
CH3COOC2H5+H2O;酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中存在Br2+H2O![]() HBr+HBrO,加入AgNO3溶液,溴水褪色
HBr+HBrO,加入AgNO3溶液,溴水褪色
B.对于平衡2SO2+O2![]() 2SO3,使用催化剂有利于SO3的合成
2SO3,使用催化剂有利于SO3的合成
C.醋酸稀溶液加热后溶液pH降低(不考虑醋酸受热挥发)
D.合成氨时适当增大压强有利于提高氮气的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图不一致的是
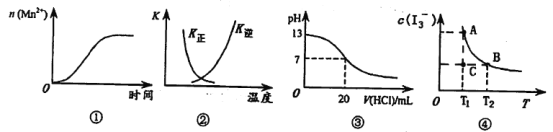
A.图①表示5 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.I2在KI溶液中存在I2(aq)+I-(aq)![]() I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
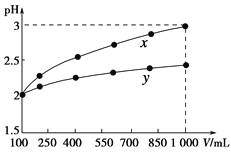
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
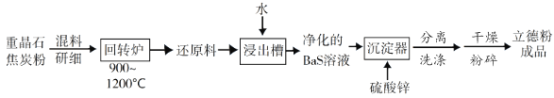
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反应式为I2+2![]() =2I+
=2I+![]() 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正)(A)=v(逆)(A)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com