
【题目】维拉佐酮是临床上使用广泛的抗抑部药,其关键中间体合成路线如下:
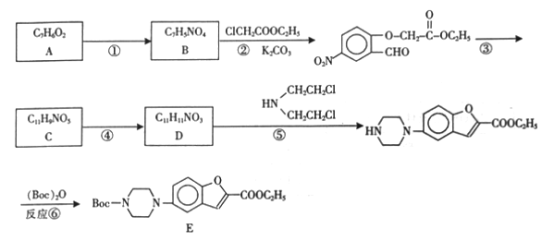
已知:R-X+![]() →
→![]() +H-X
+H-X
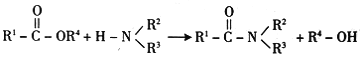
(1)下列说法正确的是______(填编号)。
A化合物A不能使三氧化铁溶液显紫色
B.反应①④⑤均为取代反应
C.合成过程中反应③与反应④不能调换
D.反应②中K2CO3的作用是使反应向正方向移动
(2)写出物质C的结构简式:__________。
(3)写出反应②的化学方程式:_____________。
(4)设计以苯和乙烯为原料制备![]() 的合成路线(用流程图表示,其他无机试剂任选)____________。
的合成路线(用流程图表示,其他无机试剂任选)____________。
(5) 经过水解和氧化后可得到分子式为C4H9O2N的物质F,写出物质F的可能的同分异构体结构简式__________。须同时符合:
经过水解和氧化后可得到分子式为C4H9O2N的物质F,写出物质F的可能的同分异构体结构简式__________。须同时符合:
①分子结构中有一个六元环;
②1H-NMR谱显示分子中有3种氢原子。
【答案】 CD ![]()
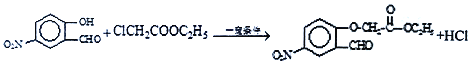

![]() 、
、![]() 、
、![]()
【解析】
本题考查有机物的推断和合成,充分利用有机物的结构进行分析解读,侧重考查学生的分析推理能力,知识迁移能力。
根据A到B再到,对比分子式和有机物的结构,可知A为![]() ,B为
,B为![]() ,反应①为硝化反应,反应②为取代反应。而由
,反应①为硝化反应,反应②为取代反应。而由 到C脱掉一分子水,再对比前后的结构,可以推出C的结构为
到C脱掉一分子水,再对比前后的结构,可以推出C的结构为![]() ,反应④发生的是硝基还原为氨基的反应,则D为
,反应④发生的是硝基还原为氨基的反应,则D为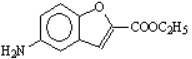 。(1) A.化合物A的结构为
。(1) A.化合物A的结构为![]() ,含有酚羟基和醛基,能使三氧化铁溶液显紫色,故错误;B.反应①为取代,④为还原反应,⑤为取代反应,故错误;C.合成过程中反应③与反应④不能调换,否则醛基有会与氢气发生加成反应,故正确;D.反应②中生成盐酸,而盐酸可以和K2CO3,所以碳酸钾的作用是使反应向正方向移动,故正确;故选CD。(2)根据以上分析可知物质C的结构简式为:
,含有酚羟基和醛基,能使三氧化铁溶液显紫色,故错误;B.反应①为取代,④为还原反应,⑤为取代反应,故错误;C.合成过程中反应③与反应④不能调换,否则醛基有会与氢气发生加成反应,故正确;D.反应②中生成盐酸,而盐酸可以和K2CO3,所以碳酸钾的作用是使反应向正方向移动,故正确;故选CD。(2)根据以上分析可知物质C的结构简式为:![]() ;
;
(3)反应②的化学方程式为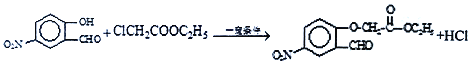 ;(4)根据题中信息可知,氨基可以和二卤代烃反应生成环,所以先生成二卤代烃和氨基。合成路线为:
;(4)根据题中信息可知,氨基可以和二卤代烃反应生成环,所以先生成二卤代烃和氨基。合成路线为: 。(5)分子式为C4H9O2N的物质F,写出物质F的可能的同分异构体结构①分子结构中有一个六元环;
。(5)分子式为C4H9O2N的物质F,写出物质F的可能的同分异构体结构①分子结构中有一个六元环;
②1H-NMR谱显示分子中有3种氢原子,则说明结构有对称性,六元环由3个碳和一个氮原子和2个氧原子形成对称位置的环,另外连接一个甲基即可,结构为![]() 或
或![]() 。或六元环由一个氮原子和一个氧原子和4个碳原子形成有对称性的环,另外连接羟基,结构为
。或六元环由一个氮原子和一个氧原子和4个碳原子形成有对称性的环,另外连接羟基,结构为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | V A | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,在这些元素中,化学性质最不活泼的是:________________(填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是_________,碱性最强的化合物是/span>_________。
(3) 最高价氧化物是两性氧化物的元素是_________。
(4) 元素④与⑥形成的化合物属于___________________ (填“共价”或“离子”)化合物。
(5)①与⑦形成的化合物的化学式 __________________。
(6)写出⑥的原子结构示意图_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定混合均匀的NH4NO3和(NH4)2SO4样品组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(溶液中的铵根离子全部转化为氨气,且加热后氨气全部逸出).加入的混合物的质量和产生的气体体积(标准状况)的关系如表:
实验序号 | I | II | III | IV |
NaOH溶液的体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=_____g;c(NaOH)=_____molL﹣1。
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙道常用氢气与纯净的金属钙加热制取,如图是模拟制取装置:
(1)为了确认进入装置C的氢气已经干燥应在B、C之间再接一装置,该装置中加入的试剂是______________。
(2)该实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,接下来的操作顺序是_______(填序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)某同学取一定质量的产物样品(m1g),加入过量碳酸钠溶液,过滤、洗涤、干燥后称量固体碳酸钙质量(m2g),计算得到样品中氢化钙的质量分数为101.14%。若该同学所有操作均正确,则产生这种情况的原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2与NO2的下列说法正确的是
A. 都能引起光化学烟雾 B. 都能使石蕊试液先变红后褪色
C. 都是酸性氧化物 D. 都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
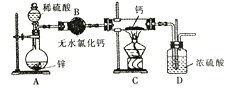
【题目】下列实验现象预测、实验设计、仪器使用能达到目的是
A. 模拟工业制氨气并检验产物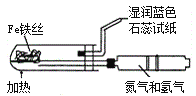
B. 实验室采用所示装置收集SO2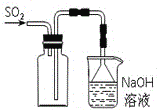
C. 验证KMnO4,Cl2,S 氧化性强弱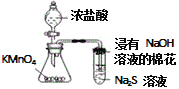
D. 验证铁发生析氢腐蚀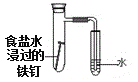
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置,测定工业纯碱(含有少量NaCl)中Na2CO3的含量.
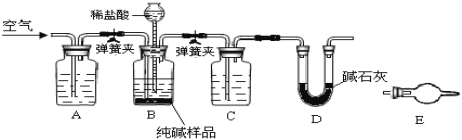
(1)检验装置B气密性:塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气.
(2)装置A的作用是____,装置C中的试剂为___.
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________.
(4)实验前称取28.80g样品,实验后D装置增重8.80g,则样品中Na2CO3质量分数为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下甲胺(CH3NH2)的电离常数kb,pkb=-lgkb=3.4。CH3NH2+H2O![]() CH3NH3++OH-。下列说法不正确的是( )
CH3NH3++OH-。下列说法不正确的是( )
A. (CH3NH3)2SO4溶液中离子浓度:c(CH3NH3+)>c(SO42-)>c(H+)>c(OH-)
B. 常温下,pH=3的盐酸溶液和pH=11的CH3NH2溶液等体积混合,混合溶液呈酸性
C. 用标准浓度的盐酸滴定未知浓度的CH3NH2溶液的实验中,选择甲基橙作指示剂
D. 常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=10.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com