
【题目】某小组设计如图所示装置,测定工业纯碱(含有少量NaCl)中Na2CO3的含量.
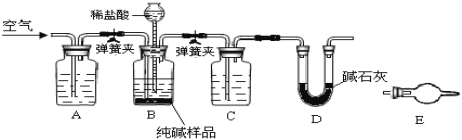
(1)检验装置B气密性:塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气.
(2)装置A的作用是____,装置C中的试剂为___.
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________.
(4)实验前称取28.80g样品,实验后D装置增重8.80g,则样品中Na2CO3质量分数为_____.
【答案】漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降 除去空气中CO2,防止影响测量结果 浓硫酸 必要 因为装置D会吸收空气中的二氧化碳和水蒸气,影响测量结果 73.6%
【解析】
根据装置图和所用试剂,该实验的反应原理为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,通过测量D装置的增重(反应生成的CO2的质量)计算Na2CO3的含量;为了减少实验误差,必须排除空气中CO2和H2O(g)对实验的干扰,以及生成的CO2中混有的H2O(g)对实验的干扰,所以①实验开始前要通入不含CO2的空气赶尽装置中的空气,②反应生成的CO2在被D装置中碱石灰吸收前要干燥,③实验结束必须通入不含CO2的空气将反应生成的CO2全部驱赶到D装置中,④D装置后要连接盛放碱石灰的干燥管,防止外界空气中CO2和H2O(g)对实验的影响;据此分析作答。
(1)根据题意,采用液差法检查装置B的气密性;塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降,说明装置不漏气。
(2)实验通过测量反应生成的CO2的质量计算Na2CO3的含量,为了减少实验误差,装置A中应盛放NaOH溶液,其作用是:除去空气中的CO2,防止影响测量结果(实验开始前用不含CO2的空气赶尽装置中空气,实验结束用不含CO2的空气将反应生成的CO2全部驱赶到D装置中)。装置C中的试剂为浓硫酸,用于除去CO2中的H2O(g)。
(3)由实验目的可知,E中可能装有碱石灰,用于吸收空气中的水和二氧化碳,防止其进入D装置干扰实验。若D装置后不连接E装置,外界空气中的CO2和H2O(g)进入D中,使测得的CO2的质量偏大,引起实验误差,故D装置后有必要连接E装置,理由是:装置D会吸收空气中的二氧化碳和水蒸气,影响测量结果。
(4)D装置增重8.80g,反应生成CO2的质量为8.80g,根据C守恒,n(Na2CO3)=n(CO2)=8.80g÷44g/mol=0.2mol,m(Na2CO3)=0.2mol×106g/mol=21.2g,样品中Na2CO3质量分数为![]() ×100%=73.6%。
×100%=73.6%。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.SiO2和CO2常温都是气体
B.CO2、SiO2均能和氢氟酸反应
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.CO2、SiO2均可与水反应制得相应酸
查看答案和解析>>
科目:高中化学 来源: 题型:
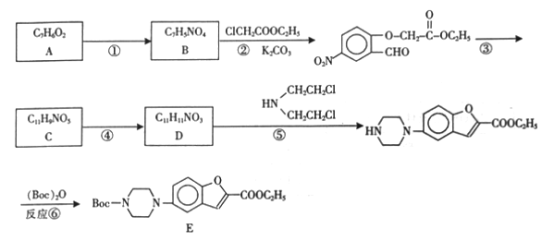
【题目】维拉佐酮是临床上使用广泛的抗抑部药,其关键中间体合成路线如下:
已知:R-X+![]() →
→![]() +H-X
+H-X
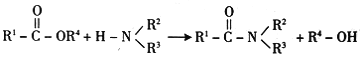
(1)下列说法正确的是______(填编号)。
A化合物A不能使三氧化铁溶液显紫色
B.反应①④⑤均为取代反应
C.合成过程中反应③与反应④不能调换
D.反应②中K2CO3的作用是使反应向正方向移动
(2)写出物质C的结构简式:__________。
(3)写出反应②的化学方程式:_____________。
(4)设计以苯和乙烯为原料制备![]() 的合成路线(用流程图表示,其他无机试剂任选)____________。
的合成路线(用流程图表示,其他无机试剂任选)____________。
(5) 经过水解和氧化后可得到分子式为C4H9O2N的物质F,写出物质F的可能的同分异构体结构简式__________。须同时符合:
经过水解和氧化后可得到分子式为C4H9O2N的物质F,写出物质F的可能的同分异构体结构简式__________。须同时符合:
①分子结构中有一个六元环;
②1H-NMR谱显示分子中有3种氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )
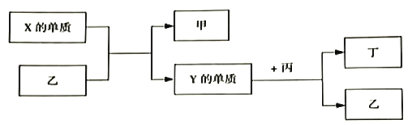
A. 原子半径由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都只能形成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如图所示(分子中的—SH与—OH具有类似的性质)。下列关于青霉氨基酸的推断合理的是( )
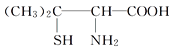
青霉氨基酸
A. 青霉氨基酸分子中所有碳原子均在同一条直线上
B. 青霉氨基酸只有酸性,没有碱性
C. 青霉氨基酸分子间能形成多肽
D. 1 mol青霉氨基酸能与足量金属钠反应放出0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。

(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式_____________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的__________曲线表示(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在澄清透明强酸性溶液中,下列各组离子能大量共存的是
A.K+、Fe2+、NO3-B.Cu2+、SO42-、NO3-C.Fe3+、Cl-、SCN- D.Na+、OH-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com