
����Ŀ����1����֪25�棺
H2S | һԪ��HA |
Ka1=9.1��10��8��Ka2=1.1��10��12�� | Ka=9.1��10��10 |
д��H2S�����KA��Һ ( A-��ʾ��� ) ��Ӧ�Ļ�ѧ����ʽ��______________________��
��2�������ᣨH3PO2����һ�ֻ�����Ʒ�����н�ǿ�Ļ�ԭ�ԡ�
��H3PO2��һԪ���ᣬд������뷽��ʽ____________________ ��
��H3PO2��NaH2PO2���ɽ���Һ�е�Ag+��ԭΪAg���Ӷ������ڻ�ѧ������NaH2PO2Ϊ________���� �����Ρ�����ʽ�Ρ���������Һ��______��������ԡ��������ԡ��������ԡ���������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4:1������������Ϊ_______���ѧʽ����
��3����NH4Al��SO4��2��Һ�еμ�1molL��1NaOH��Һ�����������ʵ��������NaOH��Һ����ı仯��ͼ��ʾ�����μӹ���������ų���
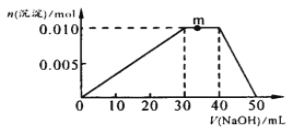
��д��m�㷢����Ӧ�����ӷ���ʽ_____________________________________��
����NH4Al��SO4��2��Һ�иļ�20mL1.2mol/L Ba��OH��2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ_____________mol ��
���𰸡�H2S��KA=KHS��HA H3PO2![]() H+��H2PO2- ���� ������ H3PO4 NH4+��OH-=NH3H2O 0.02
H+��H2PO2- ���� ������ H3PO4 NH4+��OH-=NH3H2O 0.02
��������
����ǿ��������ԭ�������볣��������Ʊ����볣��С����������ȫ�к����ɵ���Ϊ���Σ���ʽ��Ϊ����ʱ���ɵ������ӳ��������ӣ���NH4+����������ӵ��Σ���NH4Al��SO4��2��Һ�еμ�1molL-1NaOH��Һʱ���������ȳ������ڳ���֮��笠��������������������������ڹ����ļ�����ȫ�ܽ⡣
��1�������֪�������һ������̶ȴ���HA�ĵ���̶��ҵڶ�������̶�С��HA�ĵ���̶ȣ�����ǿ����������ɣ�H2S�����KA��Һ��Ӧ�Ļ�ѧ����ʽH2S��KA=KHS��HA��
��2����H3PO2��һԪ���ᣬ���뷽��ʽH3PO2![]() H+��H2PO2����
H+��H2PO2����
��H3PO2ΪһԪ���ᣬ������������ȫ�кͲ���NaH2PO2����NaH2PO2Ϊ���Σ�������Ϊǿ�������Σ�����Һ�������ԣ�
����H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4:1��ת�Ƶ���4mol����ӦΪH3PO2 +4Ag+= 4Ag��+ H3PO4������������ΪH3PO4��
��3����NH4Al��SO4��2��Һ�еμ�1molL-1NaOH��Һ��0~30mLʱ����ӦΪAl3++3OH-=Al(OH)3����30~40mLʱ�����������䣬��Ӧ��ҪΪNH4+��OH��=NH3H2O��40~50mLʱ�����������������ܽ⣬Al(OH)3+OH��=AlO2��+2H2O��
��д��m�㷢����Ӧ�����ӷ���ʽΪNH4+��OH��==NH3H2O��
�ڷ�Ӧ����0.01mol��������n(Al3+)=0.01mol�� 10mL����������Һ��笠����ӷ�Ӧ����n(NH4+)=0.01mol�������������ӵ���غ㣬n(SO42-)=0.02mol��
��NH4Al��SO4��2��Һ�иļ�20mL1.2mol/L Ba��OH��2��Һ����ַ�ӦBa2++ SO42-=BaSO4���������Ũ�Ȳ��㣬Ҫ��SO42-Ϊ������BaSO4����������Sԭ���غ�ò������������ʵ���Ϊ0.02mol ��


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�ĵ��뷽��ʽ��H2O![]() H++OH-�����������У���ȷ����
H++OH-�����������У���ȷ����
A. �����¶ȣ�Kw����pH����
B. ��ˮ�м��백ˮ��ƽ�����淴Ӧ�����ƶ���c(OH-)����
C. ��ˮ�м����������ᣬc(H+)����Kw����
D. ��ˮ�м�����������CH3COONa��ƽ�����淴Ӧ�����ƶ���c(H+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�������·ֱ���������ˮ������Ӧ�Ĺ�ͬ�����ǣ� ��
A.FeOB.Fe2O3C.Fe3O4D.Fe(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.3mol��̬����ȼ�������飨B2H6����������ȼ�գ����ɹ�̬�����������Һ̬ˮ���ų�649.5kJ��������
��1��д����Ӧ���Ȼ�ѧ����ʽ��
��2����֪H2O(l)ת��ΪH2O(g)����H��44kJ��mol��1���Լ���11.2L����״������̬��������ȫȼ��������̬ˮʱ�ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��̽��NO��Na2O2��Ӧ�Ʊ�NaNO2�����װ����ͼ����ش��������⣺

(1)��װ������������е�һ�������______��
(2)װ��A�IJ���������ɷ�______��
(3)��Ӧǰ����N2��װ��B��C��D�еĿ����ž���Ŀ����______����Ӧ��B����Һ������ԭ����______(��һ����ѧ����ʽ��ʾ)��
(4)װ��D�г�����NaNO2�⣬������һ��������______��������װ��C���ܲ���������______��Ϊ�˷�ֹ�������������װ��C��Ϊ______(���Լ�����������)��
(5)һ�������£�NH4+���Դ�����NO2���ķ�ˮ�������������塣д���йط�Ӧ�����ӷ���ʽΪ______��
(6)��֪װ��E���Լ�XΪ���Ը��������Һ����������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯���������Һ����ת����ϵ����֪B��C��D��E�Ƿǽ������ʣ����ڳ��³�ѹ�¶������壻������G����ɫ��ӦΪ��ɫ��������I��Jͨ��״���³���̬����Ӧ���ǻ��������е�һ����Ҫ�̵���Ӧ��
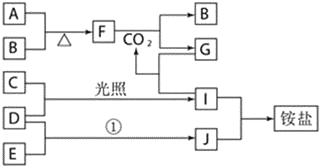
��ش��������⣺
��1��д������F������__________������E�ĵ���ʽ__________��
��2��д����������֮�䷴Ӧ�Ļ�ѧ����ʽ��
��F��CO2___________��
��D��E_______________����________����ǡ����ǡ� �����淴Ӧ��
��3������G�Ļ�ѧʽΪ______��д������I��Ӧ�����ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X�����ܱ������У���һ���¶��·������з�Ӧ:��X(s)![]() Y(g)+Z(g)����2Z(g)
Y(g)+Z(g)����2Z(g) ![]() W(g)+G(g)���ﵽƽ��ʱ��c(W)=0.25mol/L��c(Z)=4mol/L,����¶��·�Ӧ�ٵ�ƽ�ⳣ��ֵΪ
W(g)+G(g)���ﵽƽ��ʱ��c(W)=0.25mol/L��c(Z)=4mol/L,����¶��·�Ӧ�ٵ�ƽ�ⳣ��ֵΪ
A. 9 B. 16 C. 18 D. 24
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008��5��12�գ��Ĵ��봨����8.0������𣬵�������봨������ˮ����Ⱦ��ˮ��������ˮ�ľ��������������¿�����������ˮ�����������Լ���( )
A.ʯ��ˮ[Ca(OH)2]B.����
C.����[KAl(SO4)212H2O]D.���Na2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������һ�����ܱ������м���1 mol N2��3 mol H2������Ӧ��N2 + 3H2 ![]() 2NH3 ��H=��92 kJ��mol��1�������й�˵����ȷ����
2NH3 ��H=��92 kJ��mol��1�������й�˵����ȷ����
A. ���������ټ���N2�����Լӿ췴Ӧ����
B. �ﵽ��ѧ��Ӧ��ʱ����Ӧ�ų�����92 kJ
C. �ﵽ��ѧ��Ӧ��ʱ�������淴Ӧ���ʶ�Ϊ0
D. ��λʱ��������1 mol N2��ͬʱ����3 molH2��˵���÷�Ӧ�ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com