
����Ŀ��ij��ѧ��ȤС��̽��NO��Na2O2��Ӧ�Ʊ�NaNO2�����װ����ͼ����ش��������⣺

(1)��װ������������е�һ�������______��
(2)װ��A�IJ���������ɷ�______��
(3)��Ӧǰ����N2��װ��B��C��D�еĿ����ž���Ŀ����______����Ӧ��B����Һ������ԭ����______(��һ����ѧ����ʽ��ʾ)��
(4)װ��D�г�����NaNO2�⣬������һ��������______��������װ��C���ܲ���������______��Ϊ�˷�ֹ�������������װ��C��Ϊ______(���Լ�����������)��
(5)һ�������£�NH4+���Դ�����NO2���ķ�ˮ�������������塣д���йط�Ӧ�����ӷ���ʽΪ______��
(6)��֪װ��E���Լ�XΪ���Ը��������Һ����������______��
���𰸡����װ�õ������� CO2��NO2 ��ֹ������������ˮ�ȶ�ʵ��ĸ��� 3Cu+8HNO3=3Cu(NO3)2+2NO��+4H2O NaOH Na2CO3 װ�м�ʯ�ҵ����θ���� NH4++NO2��= N2��+2H2O ��ȥʣ���NO
��������
ľ̿��Ũ���ᷴӦ���ɵ�CO2��NO2�������ͨ��B�У�NO2���Ժ�H2O��Ӧ����HNO3��NO������Cu��ϡHNO3��Ӧ����NO��Ȼ��NaOH��Һ�������е�CO2���գ���ֹ����ʵ�飬��ʱʣ���������NO�������D�м���NO��Na2O2�Ƿ�Ӧ����������Ӧ��ɫ����Na2O2��Ϊ��ɫ���塣װ��ҩƷ����ͨ��һ��ʱ��ĵ������ٵμ�Ũ���ᣬ��ȼ�ƾ��ƣ����������ų�װ���еĿ�������ֹNO��������O2����ΪNO2��
��1����װ������������е�һ������Ǽ��װ�õ������ԣ��ʴ�Ϊ�����װ�õ������ԡ�
��2��װ��A�з����ķ�ӦΪľ̿��Ũ���ᷴӦ����CO2��NO2����Ӧ�Ļ�ѧ����ʽΪC +4HNO3��Ũ��![]() CO2��+4NO2��+2H2O������װ��A�IJ���������ɷ�ΪCO2��NO2���ʴ�Ϊ��CO2��NO2��
CO2��+4NO2��+2H2O������װ��A�IJ���������ɷ�ΪCO2��NO2���ʴ�Ϊ��CO2��NO2��
��3��ʵ��ʱ��ͨһ��ʱ��ĵ�����Ŀ�����ų�װ���еĿ�������ֹ������������ˮ�ȶ�ʵ��ĸ��ţ�Ȼ�����Ũ���ᣬ��ȼ�ƾ��ƣ���Ӧ��B����Һ��������ΪCu��ϡ���ᷴӦ��������ͭ��һ��������ˮ����ѧ����ʽΪ��3Cu+8HNO3=3Cu(NO3)2+2NO��+4H2O��ͭ����Ϊ��ɫ���ʴ�Ϊ����ֹ������������ˮ�ȶ�ʵ��ĸ��ţ�3Cu+8HNO3=3Cu(NO3)2+2NO��+4H2O��
��4������NOͨ������������Һ����װ��D�ǻ����ˮ������ˮ��������������Ʒ�Ӧ�����������ƺ��������������ɵĹ�������Ӧ�ú����������ƣ�������װ��C����ô������̼Ҳ����������Ʒ�Ӧ����̼���ƺ�������Ϊ�˷�ֹ�����������Ľ��ķ�������װ�м�ʯ�ҵ����θ���ܴ���װ��C���ʴ�Ϊ��NaOH��Na2CO3��װ�м�ʯ�ҵ����θ���ܡ�
��5������������ʾ��������NH4+��ˮʱ��������������Ϊ��������Ӧ�����ӷ���ʽΪNH4++NO2-=N2��+2H2O���ʴ�Ϊ��NH4++NO2-=N2��+2H2O��
��6��װ��E���Լ�XΪ���Ը��������Һ���������dz�ȥʣ���NO���������ᣬ��ֹ��Ⱦ�������ʴ�Ϊ����ȥʣ���NO��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���Ϳ�ȼ����mCH4��nH2O�����Ǹ�Ч�ྻ����Դ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1��������ӵĿռ乹��Ϊ ����ȼ����mCH4��nH2O������ ���塣
��2����֪25 �桢101 kPa ʱ��1 g������ȫȼ������Һ̬ˮ�ų�55.64 kJ��������������·�Ӧ
CH4��g)��2O2 ��g)��CO2 ��g)��2H2O ��l)�Ħ�H�� kJ/mol
��3��������·ֽ�����������̼�����ܱ������н��д˷�ӦʱҪͨ����������ʹ���ּ���ȼ�գ���Ŀ���� ��
��4���ü������������KOH��Һ)ȼ�ϵ������Դ�����CuCl2��Һ��װ����ͼ��ʾ��

��a�缫����Ϊ ��
��c�缫�ĵ缫��ӦʽΪ ��
�ۼ���CuCl2��Һ��������ij�缫������3.2 g ����Cuʱ��������ȼ�ϵ�����ĵĿ����ڱ�״���µ������ L��������O2�������ԼΪ20%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������þ��ȼ��ʵ��ʱ��ʹ�õ������ǣ� ��
A.�ԹܼС��ƾ���B.���ӡ������ƾ���
C.ȼ�ճ�D.����ǯ��ʯ�������ƾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������۲�����װ��,�ش���������:
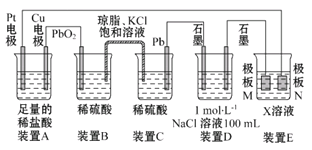
(1)װ��B��PbO2�Ϸ����ĵ缫��ӦΪ____________________________��
(2)װ��A���ܷ�Ӧ�����ӷ���ʽΪ______________________________��
(3)��װ��E��Ŀ������ͭ�϶���,��XΪ____,����N�IJ���Ϊ____��
(4)��װ��A��Cu�缫�����ı�6.4 gʱ,װ��D�в������������Ϊ____(��״��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15.2 g ͭ��þ��ɵĻ�������250 mL4.0 mol L-1��ϡ�����У�������ȫ�ܽ⣬���ɵ�����ֻ��NO����������Һ�м���1.0 L NaOH��Һ����ʱ��������ǡ�ó�����ȫ����������Ϊ25.4 g������˵������ȷ����
A. ԭ���������У�Cu��Mg�����ʵ���֮��Ϊ2��1
B. ����������Һ��Ũ��Ϊ0.8 mol��L-1
C. �����ܽ�����Һ����������ʵ���Ϊ0.1mol
D. ���ɵ�NO�����ڱ���µ����Ϊ4.48L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪25�棺
H2S | һԪ��HA |
Ka1=9.1��10��8��Ka2=1.1��10��12�� | Ka=9.1��10��10 |
д��H2S�����KA��Һ ( A-��ʾ��� ) ��Ӧ�Ļ�ѧ����ʽ��______________________��
��2�������ᣨH3PO2����һ�ֻ�����Ʒ�����н�ǿ�Ļ�ԭ�ԡ�
��H3PO2��һԪ���ᣬд������뷽��ʽ____________________ ��
��H3PO2��NaH2PO2���ɽ���Һ�е�Ag+��ԭΪAg���Ӷ������ڻ�ѧ������NaH2PO2Ϊ________���� �����Ρ�����ʽ�Ρ���������Һ��______��������ԡ��������ԡ��������ԡ���������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4:1������������Ϊ_______���ѧʽ����
��3����NH4Al��SO4��2��Һ�еμ�1molL��1NaOH��Һ�����������ʵ��������NaOH��Һ����ı仯��ͼ��ʾ�����μӹ���������ų���
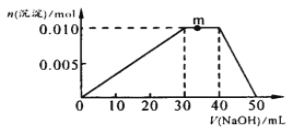
��д��m�㷢����Ӧ�����ӷ���ʽ_____________________________________��
����NH4Al��SO4��2��Һ�иļ�20mL1.2mol/L Ba��OH��2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ_____________mol ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ӦN2(g)��3H2(g) ![]() 2NH3(g)�ﵽ��ѧƽ��״̬�ı�־��
2NH3(g)�ﵽ��ѧƽ��״̬�ı�־��
A. N2��H2��NH3�������������ٸı�
B. c(N2)��c(H2)��c(NH3)��1��3��2
C. ����1 mol N��N����ͬʱ���γ�6 mol N��H��
D. N2��H2�����ʵ���֮����NH3�����ʵ�����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H<O��ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����
2SO3(g) ��H<O��ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����

A. ͼI�о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B. ͼII�о�����t0ʱ������ѹǿ��Է�Ӧ���ʵ�Ӱ��
C. ͼIII�о����Ǵ����Ի�ѧƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ�
D. ͼIII�о������¶ȶԻ�ѧƽ���Ӱ�Σ����ҵ��¶Ƚϸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ʵķ����У����ݷе㲻ͬ���з�����ǣ�������
A. ���� B. ��ȡ C. �ؽᾧ D. ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com