
【题目】认真观察下列装置,回答下列问题:
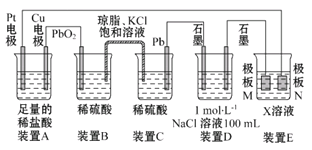
(1)装置B中PbO2上发生的电极反应为____________________________。
(2)装置A中总反应的离子方程式为______________________________。
(3)若装置E的目的是在铜上镀银,则X为____,极板N的材料为____。
(4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____(标准状况)。
【答案】PbO2+4H++SO42-+2e-=PbSO4+2H2OCu+2H+![]() Cu2++H2↑硝酸银溶液银3.92L
Cu2++H2↑硝酸银溶液银3.92L
【解析】
(1)根据装置图可知,BC是原电池,二氧化铅是正极,得到电子,电极反应式为 PbO2+4H++SO42-+2e-=PbSO4+2H2O,故答案为:PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+![]() Cu2++H2↑,故答案为:Cu+2H+
Cu2++H2↑,故答案为:Cu+2H+![]() Cu2++H2↑;
Cu2++H2↑;
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液,N是阳极,则N是银,故答案为:硝酸银溶液;银;
(4)当装置A中Cu电极质量改变6.4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,电极反应式为:2H++2e-===H2↑,则产生氢气是0.1mol。阳极是氯离子放电,电极反应式为:2Cl—2e-=Cl2↑,氯离子只有0.1mol,故当转移电子0.1mol时,氯离子放电完毕,所以阳极还有氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2,由电极反应式可得生成氯气为0.05mol、生成氧气为0.1mol÷4=0.025mol,所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L,故答案为:3.92L。


科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 硫化亚铁与稀硝酸混合反应:2H++FeS=H2S↑+ Fe2+
B. 酸化NaIO3和NaI的混合溶液,滴入几滴淀粉溶液变蓝色:5I +IO3+6H+![]() 3I2+3H2O
3I2+3H2O
C. Ba(OH)2与等物质的量 NaHSO4混合:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。
(1)写出反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44kJ·mol-1,试计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究NO与Na2O2反应制备NaNO2。设计装置如图,请回答下列问题:

(1)组装好仪器后,必须进行的一项操作是______。
(2)装置A的产生的气体成分______。
(3)反应前,用N2将装置B、C、D中的空气排净,目的是______;反应后B中溶液变蓝的原因是______(用一个化学方程式表示)。
(4)装置D中除生成NaNO2外,还有另一种杂质是______;若撤除装置C还能产生杂质是______;为了防止以上情况,可以把装置C改为______(填试剂和仪器名称)。
(5)一定条件下,NH4+可以处理含NO2-的废水,生成无毒的气体。写出有关反应的离子方程式为______。
(6)已知装置E中试剂X为酸性高锰酸钾溶液,其作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体X置于密闭容器中,在一定温度下发生下列反应:①X(s)![]() Y(g)+Z(g);②2Z(g)
Y(g)+Z(g);②2Z(g) ![]() W(g)+G(g)。达到平衡时,c(W)=0.25mol/L,c(Z)=4mol/L,则此温度下反应①的平衡常数值为
W(g)+G(g)。达到平衡时,c(W)=0.25mol/L,c(Z)=4mol/L,则此温度下反应①的平衡常数值为
A. 9 B. 16 C. 18 D. 24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0 g。

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:_____________________________。
(2)装置D中生成沉淀,发生反应的离子方程式为_________________________________。
(3)反应过程中持续通入N2的作用有两点:一是: 将装置A中产生的氨气完全导出,二是:_______________________________。
(4)若测得碱石灰的质量增加了a g,则得到碱式氯化镁的质量为_______g。
(5)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8 g,且生成的气体可直接排放到大气中,则红色固体是_______,该反应中转移电子的物质的量为_______mol。
(6)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
实验步骤 | 预期现象和结论 |
步骤1:取反应后装置C中的少许固体于试管中 | |
步骤2:____________ | ____________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com