
ЁОЬтФПЁПЃЈ1ЃЉдкДжжЦCuSO4ЁЄ5H2OОЇЬхжаГЃКЌгадгжЪFe2+ЁЃдкЬсДПЪБЮЊСЫГ§ШЅFe2+ЃЌГЃМгШыКЯЪЪбѕЛЏМСЃЌЪЙFe2+бѕЛЏЮЊFe3+ЃЌЯТСаЮяжЪПЩВЩгУЕФЪЧ________
A. KMnO4 ЁЁ B. H2O2 ЁЁЁЁ C. Cl2 ЫЎ ЁЁЁЁ D. HNO3
ШЛКѓдйМгШыЪЪЕБЮяжЪЕїећжСШмвКpH=4ЃЌЪЙFe3+зЊЛЏЮЊFe(OH)3ЃЌПЩвдДяЕНГ§ШЅFe3+ЖјВЛЫ№ЪЇCuSO4ЕФФПЕФЃЌЕїећШмвКpHПЩбЁгУЯТСажаЕФ________
A. NaOH B. NH3ЁЄH2O C. CuO D. Cu(OH)2
ЃЈ2ЃЉМзЭЌбЇЛГвЩЕїећжСШмвКpH=4ЪЧЗёФмДяЕНГ§ШЅFe3+ЖјВЛЫ№ЪЇCu2+ЕФФПЕФЃЌввЭЌбЇШЯЮЊПЩвдЭЈЙ§МЦЫуШЗЖЈЃЌЫћВщдФгаЙизЪСЯЕУЕНШчЯТЪ§ОнЃЌГЃЮТЯТFe(OH)3ЕФШмЖШЛ§Ksp=8.0ЁС10-38,Cu(OH)2ЕФШмЖШЛ§Ksp=3.0ЁС10-20ЃЌЭЈГЃШЯЮЊВаСєдкШмвКжаЕФРызгХЈЖШаЁгк1ЁС10-5 molЁЄL-1ЪБОЭШЯЮЊГСЕэЭъШЋЃЌЩшШмвКжаCuSO4ЕФХЈЖШЮЊ3.0 molЁЄL-1ЃЌдђCu(OH)2ПЊЪМГСЕэЪБШмвКЕФpHЮЊ________ЃЌFe3+ЭъШЋГСЕэЪБШмвКЕФpHЮЊ________ЃЌЭЈЙ§МЦЫуШЗЖЈЩЯЪіЗНАИ________ЃЈЬюЁАПЩааЁБЛђЁАВЛПЩааЁБЃЉ(вбжЊlg2=0.3)
ЃЈ3ЃЉЭЌбЇУЧгУ0.1000 molЁЄLЃ1ЕФЫсадИпУЬЫсМиБъзМШмвКЕЮЖЈФГЪдбљжаЙ§бѕЛЏЧтЕФКЌСПЃЌЗДгІдРэЮЊ2MnO4ЃЃЋ5H2O2ЃЋ6HЃЋ===2Mn2ЃЋЃЋ8H2OЃЋ5O2ЁќЁЃ
ЂйЕЮЖЈЕНДяжеЕуЕФЯжЯѓЪЧ______________________________________ЁЃ
ЂкгУвЦвКЙмЮќШЁ25.00 mLЪдбљжУгкзЖаЮЦПжаЃЌжиИДЕЮЖЈЫФДЮЃЌУПДЮЯћКФЕФЫсадKMnO4БъзМШмвКЬхЛ§ШчЯТБэЫљЪОЃК
ЕквЛДЮ | ЕкЖўДЮ | ЕкШ§ДЮ | ЕкЫФДЮ | |
ЬхЛ§(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
дђЪдбљжаЙ§бѕЛЏЧтЕФХЈЖШЮЊ___________molЁЄLЃ1ЁЃ
ЂлШєЕЮЖЈЧАМтзьжагаЦјХнЃЌЕЮЖЈКѓЯћЪЇЃЌдђВтЖЈНсЙћ______(ЬюЁАЦЋЕЭЁБЁЂЁАЦЋИпЁБЛђЁАВЛБфЁБ)ЁЃ
ЁОД№АИЁП B CD 4 3.3 ПЩаа ШмвКгЩЮоЩЋБфзЯЩЋЃЌЧвАыЗжжгФкВЛЛжИДдЩЋ 0.1700 ЦЋИп
ЁОНтЮіЁПЪдЬтЗжЮіЃКБОЬтПМВщбЮРрЫЎНтжЊЪЖгІгУгкЮяжЪЕФЗжРыЬсДПЃЌШмЖШЛ§ЕФМЦЫуЃЌбѕЛЏЛЙдЕЮЖЈЪЕбщЁЃ
ЃЈ1ЃЉAЯюЃЌKMnO4НЋFe2+бѕЛЏЕФРызгЗНГЬЪНЮЊMnO4-+5Fe2++8H+=Mn2++5Fe3++4H2OЃЌв§ШыдгжЪРызгЃЌВЛВЩгУЃЛBЯюЃЌH2O2НЋFe2+бѕЛЏЕФРызгЗНГЬЪНЮЊ2Fe2++H2O2+2H+=2Fe3++2H2OЃЌВЛв§ШыдгжЪЃЌВЛВњЩњЮлШОЮяЃЌПЩВЩгУЃЛCЯюЃЌCl2ЫЎНЋFe2+бѕЛЏЕФРызгЗНГЬЪНЮЊCl2+2Fe2+=2Cl-+2Fe3+ЃЌв§ШыдгжЪРызгЃЌВЛВЩгУЃЛDЯюЃЌHNO3НЋFe2+бѕЛЏЕФРызгЗНГЬЪНЮЊ3Fe2++NO3-+4H+=3Fe3++NOЁќ+2H2OЃЌВњЩњДѓЦјЮлШОЮяNOЃЌВЛВЩгУЃЛПЩВЩгУЕФЪЧBЁЃ
NaOHЁЂNH3ЁЄH2OЁЂCuOЁЂCuЃЈOHЃЉ2ЖМПЩвдЕїНкШмвКЕФpH=4ЃЌЕЋNaOHЁЂNH3ЁЄH2OЛсв§ШыдгжЪРызгЃЌЫљвдбЁгУCuOЛђCuЃЈOHЃЉ2ЃЌД№АИбЁCDЁЃ
ЃЈ2ЃЉCuЃЈOHЃЉ2ПЊЪМГСЕэЪБРызгЛ§ЕШгкCuЃЈOHЃЉ2ЕФШмЖШЛ§ЃЌKsp[CuЃЈOHЃЉ2]=cЃЈCu2+ЃЉЁЄc2ЃЈOH-ЃЉЃЌcЃЈCu2+ЃЉ=3mol/LЃЌcЃЈOH-ЃЉ=![]() =1
=1![]() 10-10mol/LЃЌcЃЈH+ЃЉ=1
10-10mol/LЃЌcЃЈH+ЃЉ=1![]() 10-4mol/LЃЌCuЃЈOHЃЉ2ПЊЪМГСЕэЪБШмвКЕФpH=-lg1
10-4mol/LЃЌCuЃЈOHЃЉ2ПЊЪМГСЕэЪБШмвКЕФpH=-lg1![]() 10-4=4ЁЃFe3+ЭъШЋГСЕэЪБcЃЈFe3+ЃЉ
10-4=4ЁЃFe3+ЭъШЋГСЕэЪБcЃЈFe3+ЃЉ![]() 1
1![]() 10-5mol/LЃЌKsp[FeЃЈOHЃЉ3]=cЃЈFe3+ЃЉЁЄc3ЃЈOH-ЃЉЃЌcЃЈOH-ЃЉ=
10-5mol/LЃЌKsp[FeЃЈOHЃЉ3]=cЃЈFe3+ЃЉЁЄc3ЃЈOH-ЃЉЃЌcЃЈOH-ЃЉ=![]() =2
=2![]() 10-11mol/LЃЌcЃЈH+ЃЉ=5
10-11mol/LЃЌcЃЈH+ЃЉ=5![]() 10-4mol/LЃЌFeЃЈOHЃЉ3ЭъШЋГСЕэЪБШмвКЕФpH=-lg5
10-4mol/LЃЌFeЃЈOHЃЉ3ЭъШЋГСЕэЪБШмвКЕФpH=-lg5![]() 10-4=3.3ЁЃИљОнМЦЫуЕФНсЙћЃЌЩЯЪіЗНАИПЩааЁЃ
10-4=3.3ЁЃИљОнМЦЫуЕФНсЙћЃЌЩЯЪіЗНАИПЩааЁЃ
ЃЈ3ЃЉЂйгЩгкKMnO4ШмвКБОЩэГЪзЯЩЋЃЌЪЕбщжаВЛашвЊМгжИЪОМСЃЌЕЮЖЈЕНДяжеЕуЕФЯжЯѓЪЧЃКШмвКгЩЮоЩЋБфзЯЩЋЃЌЧвАыЗжжгФкВЛЛжИДдЩЋЁЃ
ЂкгЩгкЕкЖўДЮЪЕбщЮѓВюНЯДѓЃЌЕкЖўДЮЪЕбщЪ§ОнТдШЅЃЌЪЕбщжаЯћКФKMnO4ШмвКЬхЛ§ЕФЦНОљжЕЮЊ![]() =17.00mLЃЌЪЕбщжаЯћКФnЃЈKMnO4ЃЉ=0.1mol/L
=17.00mLЃЌЪЕбщжаЯћКФnЃЈKMnO4ЃЉ=0.1mol/L![]() 0.017L=0.0017molЃЌИљОнЗДгІ2MnO4ЃЃЋ5H2O2ЃЋ6HЃЋ=2Mn2ЃЋЃЋ8H2OЃЋ5O2ЁќЃЌnЃЈH2O2ЃЉ=
0.017L=0.0017molЃЌИљОнЗДгІ2MnO4ЃЃЋ5H2O2ЃЋ6HЃЋ=2Mn2ЃЋЃЋ8H2OЃЋ5O2ЁќЃЌnЃЈH2O2ЃЉ=![]() nЃЈKMnO4ЃЉ=0.00425molЃЌcЃЈH2O2ЃЉ=0.00425mol
nЃЈKMnO4ЃЉ=0.00425molЃЌcЃЈH2O2ЃЉ=0.00425mol![]() 0.025L=0.1700mol/LЁЃ
0.025L=0.1700mol/LЁЃ
ЂлШєЕЮЖЈЧАМтзьжагаЦјХнЃЌЕЮЖЈКѓЯћЪЇЃЌдђЯћКФЕФKMnO4ШмвКЕФЬхЛ§ЦЋДѓЃЌВтЖЈНсЙћЦЋИпЁЃ


 гХжЪПЮЬУПьРжГЩГЄЯЕСаД№АИ
гХжЪПЮЬУПьРжГЩГЄЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A.ФЦКЭМиЕФКЯН№ПЩгУгкПьжазгЗДгІЖбзїШШНЛЛЛМС
B.ПЩгУГЌДПЙшжЦдьЕФЕЅОЇЙшРДжЦдьаОЦЌ
C.ЖўбѕЛЏЙшПЩгУгкжЦдьВЃСЇ
D.ТШЦјгаЖОЃЌВЛФмгУгквЉЮяЕФКЯГЩ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКьСзPЃЈSЃЉКЭCl2ЗЂЩњЗДгІЩњГЩPCl3КЭPCl5ЃЌЗДгІЙ§ГЬКЭФмСПЙиЯЕШчЭМЫљЪОЃЈЭМжаЕФЁїHБэЪОЩњГЩ1molВњЮяЕФЪ§ОнЃЉИљОнЩЯЭМЛиД№ЯТСаЮЪЬт

ЃЈ1ЃЉPКЭCl2ЗДгІЩњГЩPCl3ЕФШШЛЏбЇЗНГЬЪНЃК
ЃЛ
ЃЈ2ЃЉPCl5ЗжНтЩњГЩPCl3КЭCl2ЕФШШЛЏбЇЗНГЬЪНЃК
ЃЛ
ЮТЖШT1ЪБЃЌдкУмБеШнЦїжаМгШы0.8mol PCl5 ЃЌЗДгІДяЕНЦНКтЪБЛЙЪЃгр0.6mol PCl5 ЃЌЦфЗжНтТЪІС1ЕШгк
ЃЈ3ЃЉPКЭCl2ЗжСНВНЗДгІЩњГЩ1mol PCl5ЕФЁїH3= ЃЛ
PКЭCl2вЛВНЗДгІЩњГЩ1mol PCl5ЕФЁїH4 ЁїH3(ЬюЁАДѓгкЁБЃЌЁАаЁгкЁБЛђЁАЕШгкЁБ) ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЭЈЙ§NOxДЋИаЦїПЩМрВтNOxЕФКЌСПЃЌЦфЙЄзїдРэЪОвтЭМШчЯТЭМЁЃЛиД№ЯТСаЮЪЬтЃК
ЂйPtЕчМЋЩЯЛЙашЭЈШыЕФЦјЬхЪЧ________ЁЃ
ЂкаДГіNiOЕчМЋЕФЕчМЋЗДгІЪНЃК_____________________________________________ЁЃ
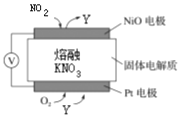
ЃЈ2ЃЉбЮЧХЕчГиЪЧвЛжжБШНЯЦеБщЕФдЕчГиЃЌИУЕчГиЗДгІдРэШчЯТЭМЫљЪОЁЃ
ЂйИКМЋЕчМЋЗДгІЪНЮЊ________ЁЃ
ЂкЕБЕчТЗжаЭЈЙ§ЕчзгЮЊ0.1molЪБЃЌСНЕчМЋжЪСПВюЮЊ___gЃЌДЫЪБдЕчГиЕчНтжЪШмвКЕФзмжЪСПгыПЊЪМЪБЕчНтжЪШмвКзмжЪСПВюжЕЮЊ___gЃЈВЛПМТЧШмвКРызгЯђбЮЧХвЦЖЏЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМзАжУжЦШЁфхБНЃЌЛиД№ЯТСаЮЪЬтЃК
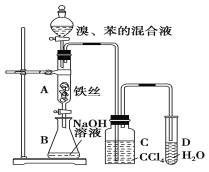
(1)аДГіAжаЗДгІЕФЛЏбЇЗНГЬЪНЃК_______________________ЃЛ
(2)CжаЪЂЗХCCl4ЕФзїгУЪЧ___________________________ЃЛ
(3)DжаМгШыЯѕЫсвјШмвКЃЌЪЕбщКѓШмвКжаФмПДЕНЕФЪЕбщЯжЯѓЮЊ_____________________ЃЛ
(4)ГЃгУгкМјБ№БНКЭМзБНЕФЪдМСЮЊ_________________ЃЛ
(5)EЮяжЪЗжзгЪНЮЊC8H10ЃЌЧвБНЛЗЩЯЕФвЛТШДњЮяжЛгавЛжжЃЌдђEЕФУћГЦЮЊ_____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЕчРыЗНГЬЪНе§ШЗЕФЪЧ
A.NaOH=NaЃЋЃЋO2ЃЃЋHЃЋB.FeCl3=Fe3ЃЋЃЋCl3Ѓ
C.Ca(NO3)2=Ca2ЃЋЃЋ2(NO3)2ЃD.NH4HSO4=NH4+ЃЋHЃЋЃЋSO42-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввЭщЃЈC2H6ЃЉзїЮЊвЛжжаТФмдДдкЛЏбЇСьгђгІгУЙуЗКЃЌЧыЛиД№ЯТСаЮЪЬтЃК(ШчЭМЫљЪОЃЌзАжУЂёЮЊввЭщШМСЯЕчГи(ЕчНтжЪШмвКЮЊKOHШмвК)ЃЌЭЈЙ§зАжУЂђЪЕЯжЬњАєЩЯЖЦЭЁЃ
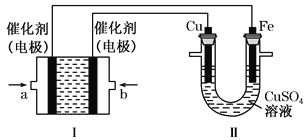
ЂйaДІгІЭЈШы______(ЬюЁАC2H6ЁБЛђЁАO2ЁБ)ЃЌaДІЕчМЋЩЯЗЂЩњЕФЕчМЋЗДгІЪНЪЧ____________________________________ЃЛ
ЂкЕчЖЦНсЪјКѓЃЌзАжУЂёжаШмвКЕФpH______(ЬюаДЁАБфДѓЁБЁАБфаЁЁБЛђЁАВЛБфЁБЃЌЯТЭЌ)ЃЌзАжУЂђжаCu2ЃЋЕФЮяжЪЕФСПХЈЖШ______ЃЛ
ЂлЕчЖЦНсЪјКѓЃЌзАжУЂёШмвКжаЕФвѕРызгГ§СЫOHЃвдЭтЛЙКЌга___________(КіТдЫЎНт)ЃЛдкДЫЙ§ГЬжаШєЭъШЋЗДгІЃЌзАжУЂђжавѕМЋжЪСПБфЛЏ12.8 gЃЌдђзАжУЂёжаРэТлЩЯЯћКФввЭщ________L(БъзМзДПіЯТ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪАДЫсЁЂМюЁЂбЮЗжРрЫГДЮХХСаЃЎе§ШЗЕФЪЧЃЈ ЃЉ
A.СђЫсЁЂДПМюЁЂЬМЫсИЦ
B.ЯѕЫсЁЂЩеМюЁЂЪГбЮ
C.БљДзЫсЁЂДПМюЁЂДзЫсФЦ
D.бЮЫсЁЂЪьЪЏЛвЁЂПСадФЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПеХЧрСЋЪЧЮвЙњжјУћЕФЛЏбЇМвЃЌ1991ФъЫћзМШЗВтЕУInЕФЯрЖддзгжЪСПЮЊ114.818ЃЌБЛЙњМЪЯрЖддзгжЪСПЮЏдБЛсВЩгУЮЊаТЕФБъзМжЕЁЃЯТСаЫЕЗЈжаЃЌДэЮѓЕФЪЧЃЈ ЃЉ
A. ![]() InЪЧInдЊЫиЕФвЛжжКЫЫи B.
InЪЧInдЊЫиЕФвЛжжКЫЫи B. ![]() InдзгКЫФкга49Иіжазг
InдзгКЫФкга49Иіжазг
C. ![]() InдзгКЫФкжЪзгЪ§КЭжазгЪ§жЎКЭЮЊ115 D.
InдзгКЫФкжЪзгЪ§КЭжазгЪ§жЎКЭЮЊ115 D. ![]() InдзгКЫЭтга49ИіЕчзг
InдзгКЫЭтга49ИіЕчзг
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com