
【题目】红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题

(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
;
温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3= ;
P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”,“小于”或“等于”) 。
【答案】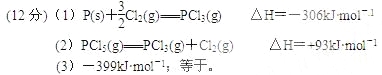
【解析】
(1)本题考查热化学反应方程式的书写,根据反应过程和能量的关系,即P和Cl2生成PCl3的热化学反应方程式为:P(s)+3/2Cl2(g)=PCl3(g) △H=-306kJ·mol-1;(2)本题考查热化学反应方程式的书写和化学平衡的计算,依据图像,以及此反应是可逆反应,PCl5分解的热化学反应方程式为:PCl5(g) ![]() PCl3(g)+Cl2(g) △H=+93 kJ·mol-1,
PCl3(g)+Cl2(g) △H=+93 kJ·mol-1,
PCl5(g) ![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
起始: 0.8 0 0
变化: 0.2 0.2 0.2
平衡:0.6 0.2 0.2 则PCl5的分解率为0.2/0.8×100%=25%;(3)本题考查盖斯定律,根据图像,△H3=△H1+△H2=(-306kJ·mol-1-93kJ·mol-1)=-399kJ·mol-1,根据盖斯定律,无论一步完成还是多步完成,只要始态和终态相同,热效应是相同,即△H4等于△H3。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是( )
A.酸性氧化物 干冰 CO2
B.碱 纯碱 Na2CO3
C.酸 硫酸 H2SO3
D.单质 氯水 Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有 __________个原子共平面;
(2)金刚烷的分子式为 ____________ ;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应①的产物名称是 __________,反应②的反应试剂和反应条件是 __________。
(4)已知烯烃能发生如下反应:

请写出下列反应产物的结构简式:
![]()
![]() ____________________________________。
____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合物:①汽油和氯化钠溶液;②乙醇的水溶液;③溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏B.分液、蒸馏、萃取
C.萃取、蒸馏、分液D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③ ______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:(__________)
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______(填“增大”、“减小”和“不变”)
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____点(填字母),并解析原因:①__________,②__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)(已知lg2=0.3)
(3)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①滴定到达终点的现象是______________________________________。
②用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___________mol·L-1。
③若滴定前尖嘴中有气泡,滴定后消失,则测定结果______(填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A. 氮气分子的电子式是:N::N:
B. 苯的结构简式是C6H6
C. 中子数为18的氯原子符号是18Cl
D. 用电子式表示NaCl的形成过程是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com