
【题目】近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③ ______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:(__________)
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______(填“增大”、“减小”和“不变”)
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____点(填字母),并解析原因:①__________,②__________。

【答案】 N2O(g) + H2(g) = N2(g) + H2O(g) ② 2NO(g) + 2CO(g) = N2(g) + 2CO2(g) △H = 747 kJ/mol C 不变 b 升高温度,平衡向吸热方向移动,即是逆向移动,c(O2)降低 升高温度,反应速率下降
【解析】(1)对于2NO(g)+2H2(g)=N2(g)+2H2O(g)分三步完成,则第三步反应由总反应式减去反应①、②得:③N2O(g) + H2(g) = N2(g) + H2O(g);整体反应速率由最慢的化学反应过程决定,因此决定此总反应速率的是第②步的反应;(2)用催化剂把NO与CO反应转化为两种对大气无污染的气体氮气和二氧化碳,反应方程式为:2NO+ 2CO= N2+ 2CO2,已知④2NO(g)+2H2(g)=N2(g)+2H2O(g) △H4=-665kJ/mol ;⑤H2(g)+CO2(g)=H2O(g)+CO(g) △H5=-41kJ/mol,根据盖斯定律,由④-⑤![]() 2得反应2NO(g) + 2CO(g) = N2(g) + 2CO2(g)△H =△H4-△H5
2得反应2NO(g) + 2CO(g) = N2(g) + 2CO2(g)△H =△H4-△H5![]() 2=-665kJ/mol -(+41kJ/mol)
2=-665kJ/mol -(+41kJ/mol)![]() 2= 747 kJ/mol;反应2NO(g) + 2CO(g) = N2(g) + 2CO2(g)为正反应为气体体积缩小的放热反应, A.适当升高温度,化学反应速率增大,平衡向逆反应方向移动,选项A不符合;B.适当降低温度,化学反应速率减小,平衡正向移动,选项B不符合;C.压缩体积增大压强,化学反应速率增大,平衡向气体体积缩小的正方向移动,选项C符合;D.使用正催化剂,化学反应速率增大,但平衡不移动,选项D不符合。答案选C;化学平衡常数只与温度有关,温度不变,K值不变;(3)由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时。反应重新达到平衡,则变为相应的点为b点,因为升高温度,平衡向吸热方向移动,即是逆向移动,c(O2)降低;升高温度,K值减小,正反应速率下降。
2= 747 kJ/mol;反应2NO(g) + 2CO(g) = N2(g) + 2CO2(g)为正反应为气体体积缩小的放热反应, A.适当升高温度,化学反应速率增大,平衡向逆反应方向移动,选项A不符合;B.适当降低温度,化学反应速率减小,平衡正向移动,选项B不符合;C.压缩体积增大压强,化学反应速率增大,平衡向气体体积缩小的正方向移动,选项C符合;D.使用正催化剂,化学反应速率增大,但平衡不移动,选项D不符合。答案选C;化学平衡常数只与温度有关,温度不变,K值不变;(3)由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时。反应重新达到平衡,则变为相应的点为b点,因为升高温度,平衡向吸热方向移动,即是逆向移动,c(O2)降低;升高温度,K值减小,正反应速率下降。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.标准状况下,1mol水的体积是22.4LB.1mol任何气体,体积均为22.4L
C.1molO2在标准状况下的体积约为22.4LD.标准状况下,气体的摩尔体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题

(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
;
温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3= ;
P和Cl2一步反应生成1mol PCl5的△H4 △H3(填“大于”,“小于”或“等于”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I是常见有机物,A是烃,E的分子式为C4H8O2,H为有香味的油状物质。
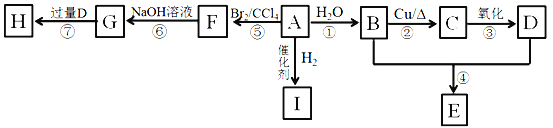
已知:CH3CH2Br+NaOH![]()
(1)0.2mol A完全燃烧生成17.6 g CO2,7.2g H2O,则A的结构简式为____________。
(2)D分子中含有官能团的名称为_____________;
(3)①的反应类型为____________
(4)G可能具有的性质为__________。
a.与钠反应 b.与NaOH溶液反应 c.易溶于水
(5)请写出②和⑦的化学方程式:
反应②_________________;
反应⑦_________________;
(6)J是有机物B的同系物,且比B多3个碳原子,J可能的结构有___种,写出其中含3个甲基可能的结构简式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
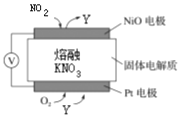
【题目】(1)通过NOx传感器可监测NOx的含量,其工作原理示意图如下图。回答下列问题:
①Pt电极上还需通入的气体是________。
②写出NiO电极的电极反应式:_____________________________________________。
(2)盐桥电池是一种比较普遍的原电池,该电池反应原理如下图所示。
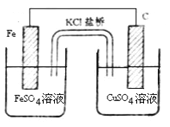
①负极电极反应式为________。
②当电路中通过电子为0.1mol时,两电极质量差为___g,此时原电池电解质溶液的总质量与开始时电解质溶液总质量差值为___g(不考虑溶液离子向盐桥移动)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置制取溴苯,回答下列问题:
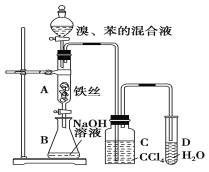
(1)写出A中反应的化学方程式:_______________________;
(2)C中盛放CCl4的作用是___________________________;
(3)D中加入硝酸银溶液,实验后溶液中能看到的实验现象为_____________________;
(4)常用于鉴别苯和甲苯的试剂为_________________;
(5)E物质分子式为C8H10,且苯环上的一氯代物只有一种,则E的名称为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷(C2H6)作为一种新能源在化学领域应用广泛,请回答下列问题:(如图所示,装置Ⅰ为乙烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
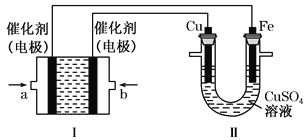
①a处应通入______(填“C2H6”或“O2”),a处电极上发生的电极反应式是____________________________________;
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有___________(忽略水解);在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗乙烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯气能将单质铁还原为氯化铁
B.盐酸既有氧化性又有还原性
C.氢气在氯气中剧烈燃烧,火焰呈苍白色,有白烟生成
D.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com