
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1D.SO3为0.4 mol·L-1
【答案】B
【解析】
A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于0.4mol/L,O2小于0.2mol/L,故A错误;
B.SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO2的浓度增大0.05mol/L, O2的浓度最多增大0.025mol/L,SO3的浓度最多减小0.05mol/L,故B正确;
C.反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误;
D.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,可逆反应中实际变化应小于该值,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________(填化学式),正极的电极反应式为____________________________;作负极的是____________________(填化学式),电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。若以反应![]() 来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。
来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
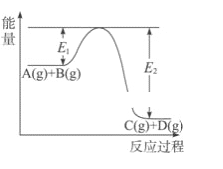
(1)该反应是___________反应(填“吸热”、“放热”)。
(2) 在反应体系中加入催化剂,化学反应速率增大,E1、E2和ΔH的变化是:E1________,E2_______,ΔH _______(填“增大”、“减小”或“不变”)
(3) 当反应达到平衡时,其他条件不变,升高温度,A的转化率______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
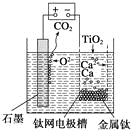
A. 由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:_______________________。
②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是________。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变______(填“深”或“浅”)。你认为证明氨水是弱碱的原因是_____________。
④请你根据所提供的试剂,再提出一个合理简便的方案证明NH3·H2O是弱电解质:_________。
(2)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(s)+3B(g)![]() 2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
A.2min末,气体D在标准状况下的体积无法计算
B.用物质B、C、D来分别表示该反应的速率之比为3:2:1
C.由于A为纯固体,物质的量浓度是常数,故无法利用A的相关物理量的变化来表示该反应的速率大小
D.单位时间内,每消耗0.3molB气体,同时消耗0.1molD气体,此时该反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com