
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
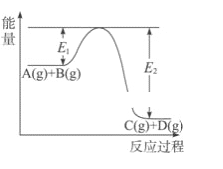
(1)该反应是___________反应(填“吸热”、“放热”)。
(2) 在反应体系中加入催化剂,化学反应速率增大,E1、E2和ΔH的变化是:E1________,E2_______,ΔH _______(填“增大”、“减小”或“不变”)
(3) 当反应达到平衡时,其他条件不变,升高温度,A的转化率______(填“增大”、“减小”或“不变”)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在温度不变时,水溶液中c(H+)和c(OH-)不能同时增大
B. pH=14的溶液是碱性最强的溶液
C. 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol/L
D. 酸或碱溶液稀释时,溶液的pH均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
A. υ(A)=0.2mol/(L·min) B. υ(B)=0.9mol/(L·min)
C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、 101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为__________________________
(2)Cl2和H2O(g))通过灼热的炭层,生成HCl和CO2,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:___________________________ .
(3)已知拆开1molH-H键,1molCl-Cl键,1molH-Cl键,分别需要的能量是436kJ、243kJ、431kJ,则Cl2与H2反应生成HCl的热化学方程式为 _______________________。
(4)已知:C(s)+O2(g) = CO2(g) ΔH=-393 kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1
写出碳和氧气生成一氧化碳的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
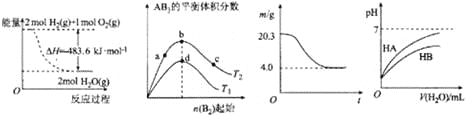
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ·mol-1
B. 图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C. 图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D. 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1D.SO3为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,根据表中所列出的元素回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
2 | a | b | c | d | |||
3 | e | f | g | h | i | j |
(1)f和d形成的物质的化学式为____。
(2)ac2分子的电子式为___。
(3)g单质溶于NaOH溶液的离子方程式为____。
(4)e单质在氧气中点燃得到淡黄色固体
①淡黄色固体的电子式为___,
②该物质存在的化学键的类型有___。
(5)为了比较该部分周素表中非金属元素的非金属性强弱,以下说法不正确的是___。
a.可以利用这些元素的最高价氧化物对应水化物的酸性比较这些元素的非金属性
b.已知j的气态氢化物水溶液的酸性比i的气态氢化物的水溶液酸性强,则非金属j>i
c.向i的气态氢化物的水溶液中加j单质,发现溶液变浑浊,则i的非金属性弱于j
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com