
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能.如图是化工生产中制备金属钼的主要流程图. 
(1)反应①的尾气可以用NH3H2O溶液吸收合成肥料,写出反应的离子方程式 .
(2)钼酸铵溶液中的主要阳离子的检验方法: .
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 .
(4)写出反应①的化学方程式: .
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 ![]() 2CO+2H2 , CH4+H2O
2CO+2H2 , CH4+H2O ![]() CO+3H2 . 含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 .
CO+3H2 . 含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 .
【答案】
(1)2NH3?H2O+SO2═2NH4++SO32﹣+H2O
(2)取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子
(3)烧杯、漏斗和玻璃棒
(4)2MoS2+7O2 ![]() 2MoO3+4SO2
2MoO3+4SO2
(5)4.11ag
【解析】解:辉钼矿(主要成分是MoS2)在空气中燃烧生成MoO3和SO2 , 二氧化硫属于酸性氧化物,能被碱液吸收,所以尾气含SO2用浓氨水吸收,二氧化硫具有还原性,则同时通入氧气生成硫酸铵;MoO3加浓氨水生成钼酸铵溶液,过滤除去杂质,在钼酸铵溶液中加足量盐酸,发生复分解反应生成钼酸和氯化铵,钼酸为难溶于水和酸的黄色晶体,过滤得到钼酸晶体高温分解生成MoO3 , 在高温条件下用氢气还原得到金属钼.
(1.)二氧化硫和一水合氨反应生成亚硫酸铵,离子反应方程式为2NH3H2O+SO2═2NH4++SO32﹣+H2O,所以答案是:2NH3H2O+SO2═2NH4++SO32﹣+H2O;
(2.)铵根离子检验方法为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子,所以答案是:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子;
(3.)如果在实验室模拟操作1和操作2,该操作为过滤,过滤时需要的玻璃仪器有烧杯、漏斗和玻璃棒,所以答案是:烧杯、漏斗和玻璃棒;
(4.)高温下,MoS2和O2发生氧化还原反应生成MoO3和SO2 , 反应方程式为2MoS2+7O2 ![]() 2MoO3+4SO2 ,
2MoO3+4SO2 ,
所以答案是:2MoS2+7O2 ![]() 2MoO3+4SO2;
2MoO3+4SO2;
(5.)根据CO2+CH4 ![]() 2CO+2H2、CH4+H2O
2CO+2H2、CH4+H2O ![]() CO+3H2知,生成(CO+H2)体积是消耗甲烷体积的4倍,CO和氢气还原MoO3制钼时,每个分子CO和H2失去电子数相同,
CO+3H2知,生成(CO+H2)体积是消耗甲烷体积的4倍,CO和氢气还原MoO3制钼时,每个分子CO和H2失去电子数相同,
含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,则甲烷转化的物质的量= ![]() =0.0321amol,
=0.0321amol,
则生成CO和氢气物质的量之和为0.1284amol,
根据转移电子守恒得生成Mo的质量= ![]() ×96g/mol=4.11ag,
×96g/mol=4.11ag,
所以答案是:4.11a g.


科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③12 C和14 C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤癸烷和十六烷 ⑥CH3(CH2)5CH3和CH3CH2CH2CH(CH3)C2H5 ⑦ 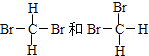 (在横线上填相应的序号) A、互为同位素的是; B、互为同分异构体的是;
(在横线上填相应的序号) A、互为同位素的是; B、互为同分异构体的是;
C、互为同素异形体的是; D、同一种物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. NaH中H的化合价:-1
B. 小苏打的化学式:NaCO3
C. 氯离子的结构示意图
D. NaClO的电离方程式:NaClO=Na++Cl-+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中提取碘的一种流程如下:

(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。

(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
【答案】 坩埚 将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤 3Ag+4H++NO![]() =3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
【解析】流程分析:海带中提碘的操作为,先灼烧海带,再水浸溶解,过滤除去不溶性杂质,得到含I-的溶液。加入硝酸银溶液沉淀I-,得到AgI沉淀,此为富集碘的过程。再向AgI固体中加入过量的铁和水,不断的搅拌,反应生成Ag单质固体和FeI2溶液,过滤,滤液为FeI2溶液,滤渣为Ag和未反应完的Fe。向滤液FeI2中通入Cl2,生成I2和FeCl3(或FeCl2);加入CCl4萃取,分液分离得到I2的CCl4溶液。
(1)图中A为坩埚;
(2)①滤渣中含有Fe和Ag,可以利用Fe和Ag的活泼性不同,用酸将二者分离。Fe与稀硫酸、盐酸反应,而Ag不反应,故可以用稀硫酸或盐酸分离Fe和Ag。具体操作为:将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤;
②Ag可以和稀硝酸反应生成AgNO3、NO和水,离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O;
(3)操作II为加入CCl4萃取,有机层为I2的CCl4溶液。CCl4的密度大于水,先将下层的有机溶液放入烧杯中,再将上层液体从上口倒出。具体操作为:打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中;
(4)可以利用KSCN检验溶液中是否含有Fe3+,具体操作为为:取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+。
【题型】综合题
【结束】
25
【题目】利用钛白工业的副产品FeSO4[杂质仅为少量[Fe2(SO4)3]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

(1)用离子方程式表示“除杂”的原理:__。
(2) “沉淀”过程控制反应温度为40℃,温度不宜过高的原因是__。
(3)实验室测定副产品FeSO4杂质仅为少量[Fe2(SO4)3]+ Fe2(SO4)3含量的步骤如下:
步骤1:将适量副产品配成水溶液,向其中加入2molL-1BaCl2溶液使SO42-沉淀完全,过滤。
步骤2:将步骤1所得沉淀洗涤,烘干至恒重,称得其质量为11.65 g。
步骤3:用0.2000molL-1KMnO4溶液与步骤1所得滤液作用,恰好完全反应时消耗其体积为20.00 mL。
(该步骤中反应的方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2++4H2O)
①步骤1中证明SO42-沉淀完全的操作为__。
②欲配制0.2000 molL-1 KMnO4 50 mL,若定容时俯视,则所配KMnO4溶液浓度会__。(填“偏大”、“偏小”、“不变”)
③该副产品中所含杂质Fe2(SO4)3的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从柑橘中可提炼得到结构为 ![]() 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )
A.分子式为C10H16
B.其一氯代物有8种
C.能与溴水发生加成反应
D.难溶于水,且密度比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中没有颜色变化的是( )
A. 木板上涂抹浓硫酸
B. 葡萄糖溶液与新制氢氧化铜悬浊液混合加热
C. 淀粉溶液中加入碘酒
D. 苯加入到酸性高锰酸钾溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com