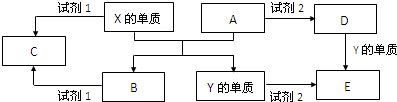
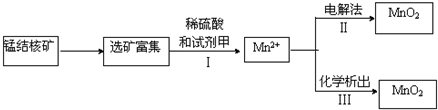
在实验室中,氮氧化物废气(主要成分NO
2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:
2NO
2+2NaOH→NaNO
2+NaNO
3+H
2O NO+NO
2+2NaOH→2NaNO
2+H
2O.(回答下列问题题)
(1)NO和NO
2的混合气体的组成可表示为NO
X ,该混合气体通入NaOH溶液被完全吸收时,x的值可以为
(填编号).a.1.1 b.1.2 c.1.5 d.1.8
(2)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO
2.2molNO和2.4molNO
2混合气体通入NaOH溶液被完全吸收时,生成的NaNO
2 是
mol;生成的NaNO
3是
mol.
(3)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO
2与1mol/LNa
2CO
3溶液50mL恰好反应生成NaNO
3,则混和气体中N
2O
4与NO
2的体积比为
.
(4)现有标准状况下a升NO
2(其中N
2O
4体积分数为20%)和b升NO的混合气恰好被200mL Na
2CO
3溶液完全吸收,则a、b应满足的关系为:
;该Na
2CO
3溶液的物质的量浓度为
mol/L(用含a、b的代数式表示).请写出纯碱溶液吸收NO
2的化学方程式:
.



 初中学业考试导与练系列答案
初中学业考试导与练系列答案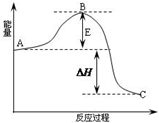 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: