


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
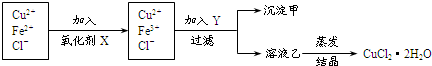
A、Mg原子结构示意图  | ||||
| B、两个硫酸根离子:SO42- | ||||
C、质子数为6、中子数为8的碳原子:
| ||||
| D、三个氧原子:3O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
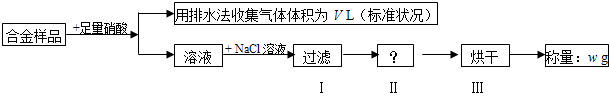
| A、收集到的V L气体全为 NO | ||
| B、过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | ||
| C、操作Ⅱ应是洗涤 | ||
D、铜的质量分数为:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
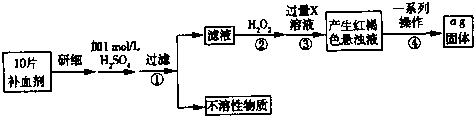
查看答案和解析>>
科目:高中化学 来源: 题型:
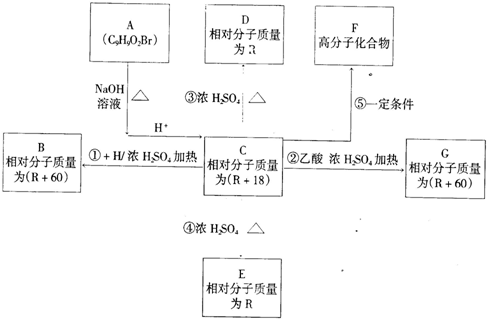
查看答案和解析>>
科目:高中化学 来源: 题型:
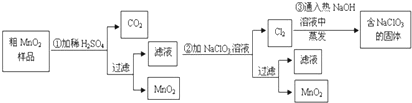
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、纤维素都是天然有机高分子化合物 |
| B、禁止使用含铅汽油是为了提高汽油的燃烧效率 |
| C、食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质 |
| D、苯酚有毒,但苯酚稀溶液可用于杀菌消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com