
【题目】下列关于节能与可再生能源表述不正确的是
A.“低碳”意指更低的二氧化碳气体的排放
B.太阳能、水能、风能都属于可再生能源
C.太阳能电池的工作原理是光能与化学能的转换
D.利用燃气轮机进行天然气发电不属于可再生能源利用
科目:高中化学 来源: 题型:
【题目】将过量的CO2分别通入①NA2SiO3溶液; ②CACl2溶液 ③CA(ClO)2溶液 ④饱和NA2CO3 溶液,最终溶液中有白色沉淀析出得是
A.①②③④ B.①④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法能达到目的的是
A.用氨水除去试管内壁上的银镜
B.用分液的方法分离乙酸乙酯和乙醇的混合物
C.用点燃的方法鉴别乙醇、苯和四氯化碳
D.用溴水鉴别苯、甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.容器中发生的反应可表示为3X(g)+Y(g) =2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氨的实验室制取和性质实验如下:

(1)实验室制取氨气的化学方程式为____。
(2)如图是实验室进行氨气溶于水的喷泉实验装置,下列叙述错误的是____。
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
(3)干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。反应的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用一玻片盖在培养皿上。下表中对实验现象的描述或所作的解释错误的是( )

选项 | 实验现象 | 解 释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了硫单质 |
C | KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃烧、机动车尾气等。因此,对PM2.5、SO2、NO等进行研究具有重要意义。回答下列问题:
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.3KJ/mol
②N2(g)+O2(g)=2NO(g) H=+180KJ/mol
CH4可用于燃烧脱硝,CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) H=_______________。
(2)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
2NO(g) H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知反应的H>0,简述该设想能否实现的依据_______________________。
③目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其化学方程式为_______________。
(3)一定温度下,在密闭容器中反应2NO2(g) ![]() N2O4(g) H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
N2O4(g) H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
在一定温度和压强下,密闭容器中N2O4和NO2的混合气体达到平衡时,c(N2O4)=0.0120mol/L(已知2NO2(g) ![]() N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 温度/℃ | c(H2O2)/ molL﹣1 | V(H2O2) /mL | m(MnO2) /g | t/min | |||||||
1 | 20 | 2 | 10 | 0 | t1 | |||||||
2 | 20 | 2 | 10 | 0.1 | t2 | |||||||
3 | 20 | 4 | 10 | 0.1 | t3 | |||||||
4 | 40 | 2 | 10 | 0.1 | t4 | |||||||
(1)设计实验2和实验3的目的是研究 对化学反应速率的影响;
(2)为研究温度对化学反应速率的影响,可以将实验 和实验 作对比(填序号);
(3)将实验1和实验2作对比,t1 t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol![]() KI溶液
KI溶液
②0.1mol![]() FeCl3溶液
FeCl3溶液
③0.1mol![]() FeCl2溶液
FeCl2溶液
④0.1mol![]() 盐酸
盐酸
⑤0.1mol![]() KSCN溶液
KSCN溶液
⑥CCl4
实验步骤:(1)取5mL 0.1mol![]() KI溶液,再滴加几滴0.1mol
KI溶液,再滴加几滴0.1mol![]() FeCl3溶液;
FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂 (填序号),现象 ,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如图所示:
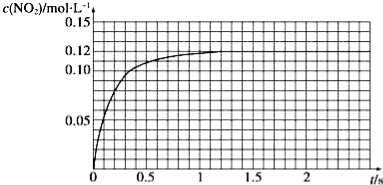
(1)反应容器中最后剩余的物质有 ,其中N2O4的物质的量为 mol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 。(选填“变大”,“变小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com