
【题目】化合物F是我国科学家研制的一种新型航空航天材料,其分子结构中含有两个六元环状结构。
合成路线如图:
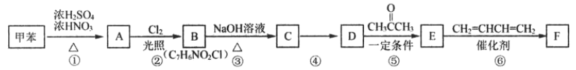
已知:Ⅰ.A分子苯环上有两种不同化学环境的氢
Ⅱ.R1—CHO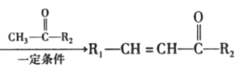 +H2O(R1、R2表示氢原子或烃基)
+H2O(R1、R2表示氢原子或烃基)
Ⅲ.![]()
Ⅳ.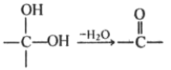
回答下列问题:
(1)A的化学名称是___。
(2)③的反应类型为___,④所需的试剂和条件是___。
(3)⑥的化学方程式为___。
(4)②得到的某种副产物,可以在NaOH溶液中直接得到D,该副产物的结构简式为___。
(5)写出符合下列条件的C的同分异构体的结构简式___、___。
①能与FeCl3溶液发生显色反应;②—NH2与苯环直接相连;③核磁共振氢谱有四组峰,且峰面积比为1:2:2:2。
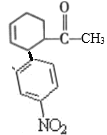
(6)参照上述流程和已有知明,以乙醛和1,3—丁二烯为原料,设计合成![]() 的路线___。
的路线___。
【答案】对硝基甲苯或4-硝基甲苯 取代反应 氧气、铜或银、加热 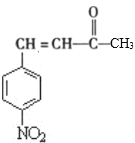 + CH2=CHCH=CH2
+ CH2=CHCH=CH2![]()
 CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]()
![]()
![]()
![]() (或其他合理答案)
(或其他合理答案)
【解析】
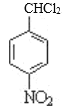
甲苯(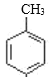 )与浓硝酸在浓硫酸作催化剂加热条件下发生硝化反应生成A,根据已知Ⅰ,A分子苯环上有两种不同化学环境的氢,A的结构简式为
)与浓硝酸在浓硫酸作催化剂加热条件下发生硝化反应生成A,根据已知Ⅰ,A分子苯环上有两种不同化学环境的氢,A的结构简式为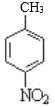 ,A与Cl2在光照的条件下发生取代反应生成B,根据B的分子式,B的结构简式为
,A与Cl2在光照的条件下发生取代反应生成B,根据B的分子式,B的结构简式为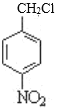 ,B与氢氧化钠溶液在加热条件下发生水解反应生成C,则C的结构简式为
,B与氢氧化钠溶液在加热条件下发生水解反应生成C,则C的结构简式为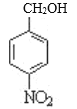 ,C在一定条件下反应生成D,D发生已知信息Ⅱ的反应,可知D中含有醛基,因此C在催化剂作用下发生氧化反应生成D,D的结构简式为
,C在一定条件下反应生成D,D发生已知信息Ⅱ的反应,可知D中含有醛基,因此C在催化剂作用下发生氧化反应生成D,D的结构简式为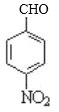 ,D与
,D与![]() 发生已知信息Ⅱ的反应生成E,则E的结构简式为
发生已知信息Ⅱ的反应生成E,则E的结构简式为 ,E与CH2=CHCH=CH2在催化剂作用下发生信息Ⅲ的反应生成F,则F的结构简式为
,E与CH2=CHCH=CH2在催化剂作用下发生信息Ⅲ的反应生成F,则F的结构简式为 ,据此分析解答。
,据此分析解答。
(1)A的结构简式为 ,化学名称是对硝基甲苯或4-硝基甲苯;
,化学名称是对硝基甲苯或4-硝基甲苯;
(2)根据分析,反应③为B与氢氧化钠溶液在加热条件下发生水解反应生成C,B中的氯原子被羟基取代,反应类型为取代反应,反应④为C在催化剂作用下发生氧化反应生成D,所需的试剂和条件是氧气、铜或银、加热;
(3)反应⑥为E与CH2=CHCH=CH2在催化剂作用下发生信息Ⅲ的反应生成F,化学反应方程式为: + CH=CHCH=CH2
+ CH=CHCH=CH2![]()
 ;
;
(4)D的结构简式为 ,反应②为A与氯气发生取代反应生成B,得到产物B的结构简式为
,反应②为A与氯气发生取代反应生成B,得到产物B的结构简式为 ,其某种副产物,可以在NaOH溶液中直接得到D,即该副产物在氢氧化钠溶液中直接可以变为醛基,根据已知信息Ⅳ,同一个碳原子上的两个羟基脱水可得到碳氧双键,则反应②中的副产物应为
,其某种副产物,可以在NaOH溶液中直接得到D,即该副产物在氢氧化钠溶液中直接可以变为醛基,根据已知信息Ⅳ,同一个碳原子上的两个羟基脱水可得到碳氧双键,则反应②中的副产物应为 ,
, 在NaOH溶液中可发生取代反应生成连个羟基连在一个碳上,再发生已知信息Ⅳ的反应生成
在NaOH溶液中可发生取代反应生成连个羟基连在一个碳上,再发生已知信息Ⅳ的反应生成 ;
;
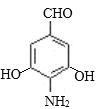
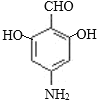
(5)C的结构简式为 其同分异构体能与FeCl3溶液发生显色反应,说明结构中含有苯环和酚羟基,—NH2与苯环直接相连,核磁共振氢谱有四组峰,且峰面积比为1:2:2:2,则符合要求的同分异构体为
其同分异构体能与FeCl3溶液发生显色反应,说明结构中含有苯环和酚羟基,—NH2与苯环直接相连,核磁共振氢谱有四组峰,且峰面积比为1:2:2:2,则符合要求的同分异构体为 、
、 ;
;
(6)参照上述流程和已有知明,以乙醛和1,3—丁二烯为原料合成![]() ,先由CH3CHO在一定条件下发生已知信息Ⅱ的反应转化为CH3CH=CHCHO,再与CH2=CHCH=CH2在催化剂作用下生成
,先由CH3CHO在一定条件下发生已知信息Ⅱ的反应转化为CH3CH=CHCHO,再与CH2=CHCH=CH2在催化剂作用下生成![]() ,在与Ag(NH3)2OH发生银镜反应,最后进行酸化生成
,在与Ag(NH3)2OH发生银镜反应,最后进行酸化生成![]() ,则合成路线为:CH3CHO
,则合成路线为:CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]()
![]()
![]()
![]() (或其他合理答案)。
(或其他合理答案)。


科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
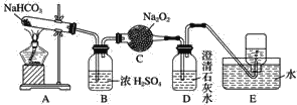
(1)A中现象是________________________________。
(2)B中浓硫酸的作用是__________________________。
(3)C中发生反应的化学方程式为____________________________________。
(4)D中的现象是______________________________。
(5)E中收集的气体是____________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,1]戊烷(![]() )是其中的一种。下列关于该化合物的说法不正确的是
)是其中的一种。下列关于该化合物的说法不正确的是
A.与1,3-戊二烯互为同分异构体
B.分子中所有碳原子不可能处于同一平面内
C.二氯代物共有4种
D.碳碳键只有单键且彼此之间的夹角有60°和120°两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]易溶于水,在定量分析中常用来配制亚铁离子的标准溶液。某化学课外小组同学设计并完成下列实验。
I.(NH4)2Fe(SO4)2·6H2O的制取
实验步骤:
①称取4.2g碎铁屑于锥形瓶中,加入10mL30%的NaOH溶液,加热煮沸-段时间。倾去碱液,水洗至中性。
②向处理过的铁屑中加入25mL3mol/LH2SO4,水浴加热至反应完全,趁热过滤。
③向滤液中加入-定体积的饱和(NH4)2SO4溶液,加热浓缩,冷却,抽滤,洗涤,干燥得产品。
(1)步骤①中加入NaOH溶液的目的是___。
(2)步骤②趁热过滤的目的是___。
(3)步骤③加热浓缩溶液时,需要的仪器有酒精灯、___、___(固定、夹持仪器除外)。
Ⅱ.(NH4)2Fe(SO4)2·6H2O和FeSO4·7H2O稳定性的对比研究
如图,在2支相同的注射器中分别装入等物质的量的两种晶体,调整2支注射器活塞使空气体积相等,用针头及胶塞封好注射器(气密性良好)。较长时间后,取出两种晶体,分别滴加2滴0.01mol/LKSCN溶液。整个过程中实验现象记录如下:
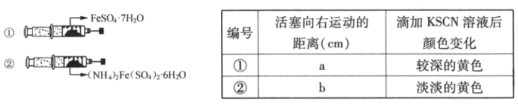
(4)判断a___b(填“>”、“<”或“=”),出现此结果的原因可能是___。
(5)判断此条件下(NH4)2Fe(SO4)2·6H2O的稳定性___(填“大于”或“小于”)FeSO4·7H2O。
Ⅲ.配制(NH4)2Fe(SO4)2溶液并标定浓度
配制(NH4)2Fe(SO4)2溶液100mL,准确量取20.00mL,置于锥形瓶中,加10mLH2SO4和邻二氮菲指示剂3~4滴,用cmol/LK2Cr2O7标准液滴定至溶液变成棕红色。消耗K2Cr2O7溶液的体积为VmL。
(6)计算(NH4)2Fe(SO4)2溶液的浓度为___ mol/L。
(7)下列操作会使所测溶液浓度偏大的是___(填标号)。
A.锥形瓶用待测溶液润洗
B.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
C.滴定过程中剧烈摇晃锥形瓶,溶液溅出
D.滴定前平视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某烷烃的相对分子质量为72。回答下列问题:
(1)写出该烷烃的分子式__。
(2)写出其同分异构体的结构简式__。
(3)若此烷烃的一氯代物分子中有三个—CH3,一个—CH2—,其结构简式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
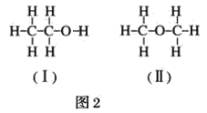
【题目】为了测定乙醇的结构式,利用乙醇和钠的反应,设计如图1装置进行实验,在烧瓶中放入足量的钠,从分液漏斗中缓缓滴入一定量的乙醇,通过测量量筒中水的体积,就可知反应生成的氢气的体积。
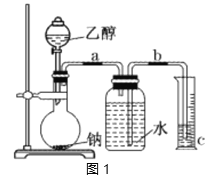
(1)实验前检验该装置的气密性的实验操作是__。
(2)有人认为装置中有空气,所测的气体体积应扣除装置中空气的体积,才是氢气的体积,你认为__(填“正确”或“不正确”)。
(3)若实验中所用乙醇含有少量水则实验结果将_(填“偏大”或“偏小”),若实验开始前b导管内未充满水则实验结果将__(填“偏大”或“偏小”)。
(4)若测得有1.15gC2H6O参加反应,把量筒c中的水的体积换算成标准状况下H2的体积为280mL,试结合计算和讨论,判断图2中(Ⅰ)和(Ⅱ)两式中,哪个正确__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6 g铁粉投入足量的100 mL 2 mol·L-1稀硫酸中,2 min时铁粉刚好完全溶解。下列有关这个反应的反应速率表示正确的是( )
A. 铁的反应速率=0.5 mol·L-1·min-1
B. 硫酸的反应速率=0.25 mol·L-1·min-1
C. 硫酸亚铁的生成速率=0.5 mol·L-1·min-1
D. 氢气的反应速率=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com