
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
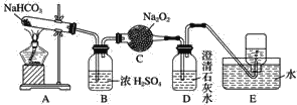
(1)A中现象是________________________________。
(2)B中浓硫酸的作用是__________________________。
(3)C中发生反应的化学方程式为____________________________________。
(4)D中的现象是______________________________。
(5)E中收集的气体是____________(填名称)。
【答案】试管口有水珠 干燥二氧化碳 2CO2+2Na2O2=2Na2CO3+O2 石灰水变浑浊 氧气
【解析】
NaHCO3受热分解生成的水蒸气在A中的试管口冷凝为水珠,而CO2通过浓H2SO4干燥后与C中的Na2O2反应产生O2,未完全反应的CO2会使石灰水变浑浊,用排水法收集氧气,以此解答该题。
(1)加热碳酸氢钠固体,分解生成二氧化碳和水,冷却后,可观察到试管口有水珠,
故答案为:试管口有水珠;
(2)浓硫酸具有吸水性,可用于干燥二氧化碳,
故答案为:干燥二氧化碳;
(3)C中发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,
故答案为:2CO2+2Na2O2=2Na2CO3+O2;
(4)二氧化碳与石灰水反应生成碳酸钙沉淀,可观察到石灰水变浑浊,
故答案为:石灰水变浑浊;
(5)过氧化钠与二氧化碳反应生成氧气,不溶于水,可收集到氧气,
故答案为:氧气。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体。并将A、B、C按如图所示装置连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
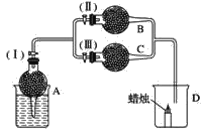
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是______________。
(2)在装置B中的淡黄色粉末是______________。
(3)在干燥管C中的白色固体应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H =—373.20kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+2CO2(g) △H =—373.20kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100mL同浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如表(气体体积均在标准状况下测定)。
① | ② | ③ | |
铝热剂质量/g | 7.5 | 15.0 | 20.0 |
气体体积/L | 3.36 | 6.72 | 6.72 |
计算:
(1)NaOH溶液物质的量浓度_______
(2)该铝热剂中铝的质量分数_______
(3)15g该铝热剂发生铝热反应理论上产生铁的质量。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的性质是了解工农业生产的重要基础。设NA为阿伏加德罗常数的值,下列有关说法错误的是( )
A.标准状况下,5.6LNO与5.6LO2充分混合后的分子数为0.5NA
B.标准状况下,22.4L15NH3含有的质子数为10NA
C.13.8gNO2与足量水反应,转移的电子数为0.2NA
D.常温下,1L0.1mol·L1NH4NO3溶液中含有的氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.01mol·L-1一元酸HR溶液中逐渐通入氨气[常温下NH3·H2O电离平衡常数K=1.76×10-5],保持温度和溶液体积不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述不正确的是
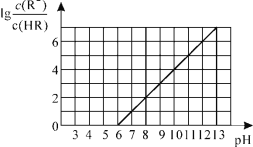
A.0.01mol·L-1HR溶液的pH约为4
B.随着氨气的通入,![]() 逐渐减小
逐渐减小
C.当溶液为碱性时,c(R-)>c(HR)
D.当通入0.01 mol NH3时,溶液中存在:c(R-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:![]() ,请回答下列问题:
,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:![]() ,
,![]() ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为![]() ,求此时N的转化率____。
,求此时N的转化率____。
(2)若反应温度不变,反应物的起始浓度分别为:![]() ,
,![]() ,达到平衡后,
,达到平衡后,![]() ,求a的值____。
,求a的值____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠和氯化钠的固体混合物共4 g,把它们加强热到质量不再减轻为止,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生二氧化碳0.88 g。回答下列问题:
(1)固体质量减轻了__________g,这是因为发生了反应__________________________(写化学方程式),从化学方程式可计算出原混合物中碳酸氢钠的质量是__________g,加热后新增加了碳酸钠__________g。
(2)残余固体中加入过量盐酸的化学方程式为__________________,通过已知条件“产生的二氧化碳为0.88 g”可以计算出参加反应的碳酸钠是____________g,因为其中有____________g 碳酸钠是加热碳酸氢钠产生的,故原混合物中含碳酸钠____________g。
(3)原混合物中含氯化钠____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是我国科学家研制的一种新型航空航天材料,其分子结构中含有两个六元环状结构。
合成路线如图:
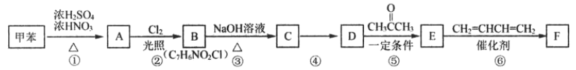
已知:Ⅰ.A分子苯环上有两种不同化学环境的氢
Ⅱ.R1—CHO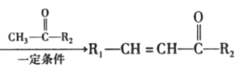 +H2O(R1、R2表示氢原子或烃基)
+H2O(R1、R2表示氢原子或烃基)
Ⅲ.![]()
Ⅳ.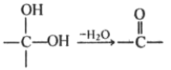
回答下列问题:
(1)A的化学名称是___。
(2)③的反应类型为___,④所需的试剂和条件是___。
(3)⑥的化学方程式为___。
(4)②得到的某种副产物,可以在NaOH溶液中直接得到D,该副产物的结构简式为___。
(5)写出符合下列条件的C的同分异构体的结构简式___、___。
①能与FeCl3溶液发生显色反应;②—NH2与苯环直接相连;③核磁共振氢谱有四组峰,且峰面积比为1:2:2:2。
(6)参照上述流程和已有知明,以乙醛和1,3—丁二烯为原料,设计合成![]() 的路线___。
的路线___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com