
【题目】碳酸钠、碳酸氢钠和氯化钠的固体混合物共4 g,把它们加强热到质量不再减轻为止,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生二氧化碳0.88 g。回答下列问题:
(1)固体质量减轻了__________g,这是因为发生了反应__________________________(写化学方程式),从化学方程式可计算出原混合物中碳酸氢钠的质量是__________g,加热后新增加了碳酸钠__________g。
(2)残余固体中加入过量盐酸的化学方程式为__________________,通过已知条件“产生的二氧化碳为0.88 g”可以计算出参加反应的碳酸钠是____________g,因为其中有____________g 碳酸钠是加热碳酸氢钠产生的,故原混合物中含碳酸钠____________g。
(3)原混合物中含氯化钠____________g。
【答案】0.62 2NaHCO3![]() Na2CO3+H2O+CO2↑ 1.68 1.06 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 2.12 1.06 1.06 1.26
Na2CO3+H2O+CO2↑ 1.68 1.06 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 2.12 1.06 1.06 1.26
【解析】
由于混合物中发生反应2NaHCO3![]() Na2CO3+H2O+CO2↑,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量。
Na2CO3+H2O+CO2↑,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量。
(1)加热发生反应:2NaHCO3![]() Na2CO3+H2O+CO2↑导致固体质量减少,质量减少:4g-3.38g=0.62g,设混合物中有NaHCO3的质量为x,生成Na2CO3的质量为y,
Na2CO3+H2O+CO2↑导致固体质量减少,质量减少:4g-3.38g=0.62g,设混合物中有NaHCO3的质量为x,生成Na2CO3的质量为y,
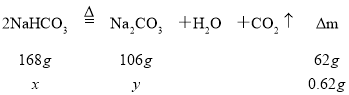
解得x=1.68g,y=1.06g,故答案为:0.62g;2NaHCO3![]() Na2CO3+H2O+CO2↑;1.68;1.06;
Na2CO3+H2O+CO2↑;1.68;1.06;
(2)在残余固体中加入过量的盐酸,产生二氧化碳0.88g,即0.02mol,根据碳守恒,和盐酸反应的加热后碳酸钠的总物质的量为0.02mol,质量是0.02mol×106g/mol=2.12g。则原混合物中碳酸钠的质量=2.12g-1.06g=1.06g,故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;2.12g ;1.06g;1.06g;
(3)原混合物中含碳酸氢钠的质量为1.68g,碳酸钠的质量为1.06g,则氯化钠的质量=4g-1.68g-1.06=1.26g,故答案为:1.26g;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、Al3+、Br-、CH3COO-
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、Cl-
、Cl-
C.0.1mol·L-1NaHSO3溶液中:Na+、NH![]() 、ClO-、MnO
、ClO-、MnO![]()
D.0.1mol·L-1Fe(NO3)3溶液中:Cu2+、Fe2+、SCN-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
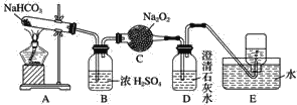
(1)A中现象是________________________________。
(2)B中浓硫酸的作用是__________________________。
(3)C中发生反应的化学方程式为____________________________________。
(4)D中的现象是______________________________。
(5)E中收集的气体是____________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
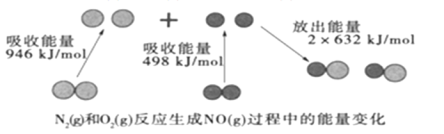
下列说法中正确的是( )
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJmol-1、-285.8kJmol-1。CO与H2合成甲醇的能量变化如图甲所示:
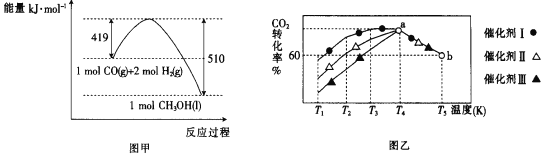
则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
650 | 4 | 2 | 1.6 | 10 | |
900 | 3 | 2 |
| 5 | |
900℃时,达到平衡时的反应速率v(H2O)=____。(保留2位小数)。
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____。
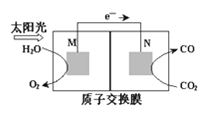
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属活动性顺序是学习化学的重要工具,在工农业生产和科学研究中有重要应用。常见的金属活动性顺序如下:
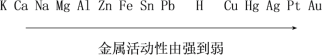
(1)解释不能用铁制容器配制硫酸铜溶液的原因(用化学方程式表示:____________________;
(2)验证镁比锌的金属活动性强,应选用的溶液是________;
(3)从金属活动性顺序中你还能获得哪些信息?(写出一条即可):______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,1]戊烷(![]() )是其中的一种。下列关于该化合物的说法不正确的是
)是其中的一种。下列关于该化合物的说法不正确的是
A.与1,3-戊二烯互为同分异构体
B.分子中所有碳原子不可能处于同一平面内
C.二氯代物共有4种
D.碳碳键只有单键且彼此之间的夹角有60°和120°两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6 g铁粉投入足量的100 mL 2 mol·L-1稀硫酸中,2 min时铁粉刚好完全溶解。下列有关这个反应的反应速率表示正确的是( )
A. 铁的反应速率=0.5 mol·L-1·min-1
B. 硫酸的反应速率=0.25 mol·L-1·min-1
C. 硫酸亚铁的生成速率=0.5 mol·L-1·min-1
D. 氢气的反应速率=0.5 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com