
【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100mL同浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如表(气体体积均在标准状况下测定)。
① | ② | ③ | |
铝热剂质量/g | 7.5 | 15.0 | 20.0 |
气体体积/L | 3.36 | 6.72 | 6.72 |
计算:
(1)NaOH溶液物质的量浓度_______
(2)该铝热剂中铝的质量分数_______
(3)15g该铝热剂发生铝热反应理论上产生铁的质量。_______
【答案】NaOH溶液物质的量浓度为2mol·L-1 该铝热剂中铝的质量分数为36% 15g该铝热剂发生铝热反应理论上产生铁的质量为6.72g
【解析】
铝热剂加入NaOH溶液中发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(1)由②③组数据可知NaOH完全反应,根据氢气的体积可计算NaOH溶液物质的量浓度;
(2)根据①组数据计算,①中NaOH剩余,Al完全反应根据化学方程式可计算Al的质量,进而可计算质量分数;
(3)根据(2)Al的质量分数可计算生成铁的质量.
(1)铝热剂加入NaOH溶液中发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由②③组数据可知NaOH完全反应,n(H2)=![]() =0.3mol,
=0.3mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(NaOH) 0.3mol
n(NaOH)=0.2mol,
c(NaOH)=![]() =2mol·L-1,
=2mol·L-1,
答:NaOH溶液物质的量浓度为2mol·L-1;
(2)①中NaOH剩余,Al完全反应,n(H2)=![]() =0.15mol,
=0.15mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,m(Al)=0.1mol×27g·mol-1=2.7g,ω(Al)=![]() ×100%=36%,
×100%=36%,
答:该铝热剂中铝的质量分数为36%;
(3)15 g铝热剂中含n(Al)=![]() =0.2 mol,m(Al)=15g×36%=5.4g,m(Fe2O3)=15g-5.4g=9.6g,n(Fe2O3)=
=0.2 mol,m(Al)=15g×36%=5.4g,m(Fe2O3)=15g-5.4g=9.6g,n(Fe2O3)=![]() =0.06mol,则Al过量,
=0.06mol,则Al过量,
Fe2O3+2Al![]() 2Fe+Al2O3,
2Fe+Al2O3,
1mol 2mol
0.06 mol n(Fe)
n(Fe)=0.12mol
m(Fe)=0.12mol×56g·mol-1=6.72g,
答:15 g该铝热剂发生铝热反应理论上产生铁的质量为6.72 g。


科目:高中化学 来源: 题型:
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、Al3+、Br-、CH3COO-
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、Cl-
、Cl-
C.0.1mol·L-1NaHSO3溶液中:Na+、NH![]() 、ClO-、MnO
、ClO-、MnO![]()
D.0.1mol·L-1Fe(NO3)3溶液中:Cu2+、Fe2+、SCN-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3—丙基—5,6—二羟基异香豆素的一种合成路线如图:
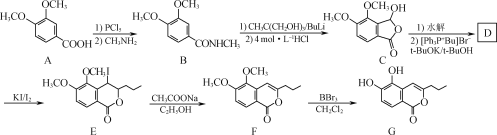
已知:Ⅰ. ;
;
Ⅱ.Ph3P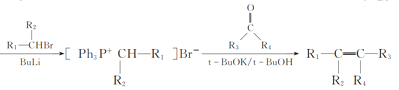
Ph为苯基,Bu为CH3CH2CH2CH2—,t—Bu为(CH3)3C—,R1~R4为烃基或H
(1)A中含氧官能团的名称为____和___。
(2)E→F的反应类型为__。
(3)D的分子式为C14H18O4,写出其结构简式:___。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___(只写一种)。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,两种水解产物分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和Ph3P为原料制备
和Ph3P为原料制备![]() 的合成路线流程图___(无机试剂、有机催化剂及溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂、有机催化剂及溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。
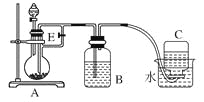
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生产麦芽酚废渣[主要含Mg(OH)Br,以及少量NH4Cl和不溶于水的有机溶剂等]制取溴乙烷的实验流程如图:
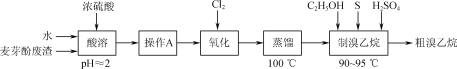
(1)“酸溶”时,水与废渣的质量比约为2∶1,加水量不宜过少的原因是___。
(2)“操作A”的名称是____。
(3)“蒸馏”出Br2时,最适合的加热方法是____。
(4)“制溴乙烷”的装置如图所示:
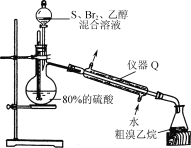
①图中仪器Q的名称是____。
②烧瓶中生成溴乙烷、硫酸的化学方程式为___。
(5)设计将粗溴乙烷进行纯化的实验方案:___,得纯净干燥的溴乙烷[实验中必须使用的试剂:蒸馏水、无水CaCl2、1%的NaOH溶液]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
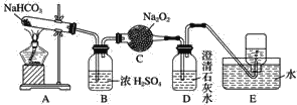
(1)A中现象是________________________________。
(2)B中浓硫酸的作用是__________________________。
(3)C中发生反应的化学方程式为____________________________________。
(4)D中的现象是______________________________。
(5)E中收集的气体是____________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
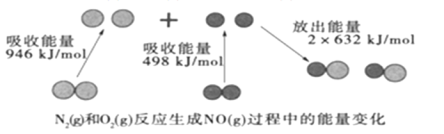
下列说法中正确的是( )
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,1]戊烷(![]() )是其中的一种。下列关于该化合物的说法不正确的是
)是其中的一种。下列关于该化合物的说法不正确的是
A.与1,3-戊二烯互为同分异构体
B.分子中所有碳原子不可能处于同一平面内
C.二氯代物共有4种
D.碳碳键只有单键且彼此之间的夹角有60°和120°两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com