
【题目】某金属A及其化合物之间有如下的转化关系:

(1)请写出A、B、C的化学式:A.__________;B.__________;C._________
(2)写出A与B反应的离子方程式:_________________________________
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①CH3CH2CH3 ②CH3CH2CH2CH3 ③CH3CH2CH2CH2CH3 ④![]()
⑤ ⑥CH3CH2CH2CH2CH2CH3
⑥CH3CH2CH2CH2CH2CH3
上述物质的沸点按由高到低的顺序排列的是( )
A. ⑥③④⑤②① B. ⑥③②①④⑤ C. ⑤④⑥③②① D. ⑥⑤④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 和
和![]() 的混合气体中含电子总数为
的混合气体中含电子总数为![]()
B.![]() 氢化钾
氢化钾![]() 与足量水反应转移电子数为
与足量水反应转移电子数为![]()
C.92g甘油![]() 丙三醇
丙三醇![]() 中含C一H键总数为
中含C一H键总数为![]()
D.![]() 溶液中
溶液中![]() 和
和![]() 数之和为
数之和为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,
为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,![]() 同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
A.纯净的E元素的最高价氧化物可用于制造光导纤维
B.![]() 三种元素形成的化合物中一定只含共价键
三种元素形成的化合物中一定只含共价键
C.由元素![]() 组成的某种化合物可与
组成的某种化合物可与![]() 反应生成
反应生成![]()
D.元素A与![]() 形成的常见化合物中,热稳定性最好的是AD
形成的常见化合物中,热稳定性最好的是AD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
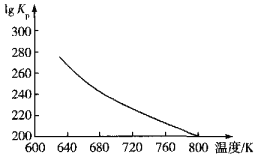
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2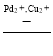 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
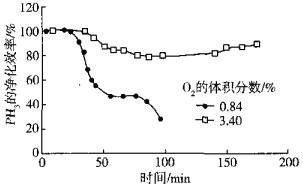
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电池工作时,下列说法错误的

A. 甲池中N极的电极反应式为:O2+4e-+4H+=2H2O
B. 当N极消耗5.6L(标准状况下)O2时,铁极增重32g
C. 电子的流动方向为M→Fe→CuSO4溶液→Cu→N
D. M极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素并且原子序数依次增大,其中只有A、B、C在同一周期。A元素原子核外成对电子数是未成对电子数的2倍;B元素最外层有3个未成对电子;C元素核外有3对成对电子;D元素是所在周期中原子半径最小的;E元素位于周期表的第四周期第九列。请根据相关信息,应化学用语回答下列问题:
(1)A的基态原子核中核外有___种运动状态不同的电子;B的基态原子中电子占据最高能级的电子云轮廓图为____。D的基态原子核外有____种能量不同的电子。
(2)B的氢化物BH3的VSEPR模型为____,其分子空间构型为_____;A、B、C三种元素的第一电离能由大到小的顺序为_____(填元素符号)。
(3)BO2-中B原子的杂化轨道类型为____;与AB-互为等电子体的分子有_____,离子有_____。(分别写出1种)
(4)由A、C与氢形成H2A2C4分子中,1mol该分子中含有π键的数目为____。
(5)E元素位于元素周期表中的___区,E3+的一种配离子[E(BH3)5D]2+中,E3+的配位数为____,配位原子为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com