
【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)天然气是目前应用较为广泛的能源之一,天然气中除含主要成分甲烷外,还含有乙烷、丙烷等,乙烷的电子式为 。
(2)碳酸和草酸均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3 | H2C2O4 | |
K1 | 4.2×107 | 5.4×102 |
K2 | 5.6×1011 | 5.4×105 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为 。
②浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为 。
(3)常温时,C和CO的标准燃烧热分别为394.0 kJ·mol1、283.0 kJ·mol1,该条件下C转化为CO的热化学方程式为 。
(4)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:
2H2(g)+CO(g)![]() CH3OH(g) ΔH=Q kJ·mol1
CH3OH(g) ΔH=Q kJ·mol1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 300 | 350 |
K/L2·mol2 | 2.041 | 0.270 | 0.012 |
由此可判断Q (选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L1,该温度下的平衡常数K= ,0~10 min内反应速率v(CH3OH)= 。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

A、B两点的压强大小关系:p1 (选填“ >”、“=”或“<”)p2。若A点对应容器的容积为20 L,则B点对应容器的容积为 L。
【答案】(1) 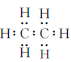
(2)①H2C2O4+2![]()
![]() 2
2![]() +
+![]() ②c4>c3>c2>c1
②c4>c3>c2>c1
(3)2C(s)+O2(g) ![]() 2CO(g) ΔH=222.0 kJ·mol1
2CO(g) ΔH=222.0 kJ·mol1
(4)①< ②2.041 L2·mol2 0.08 mol·L1·min1 ③< 4
【解析】本题考查物质性质与化学反应原理,意在考查考生对化学理论知识的综合应用能力。 (1)乙烷为共价化合物,其中H原子核外达到2电子稳定状态,C原子核外为8电子稳定状态,故其电子式为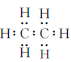 。
。
(2)①![]() 的酸性比H2CO3强,若草酸过量,则生成二氧化碳,但该题中草酸为少量,故反应生成
的酸性比H2CO3强,若草酸过量,则生成二氧化碳,但该题中草酸为少量,故反应生成![]() 和
和![]() 。②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>
。②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>![]() >H2CO3>
>H2CO3>![]() ,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1。
,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1。
(3)由已知C和CO的标准燃烧热数据可写出其热化学方程式:①C(s)+O2(g) ![]() CO2(g) ΔH=394.0 kJ·mol1、②CO(g)+
CO2(g) ΔH=394.0 kJ·mol1、②CO(g)+![]() O2(g)
O2(g) ![]() CO2(g) ΔH=283.0 kJ·mol1,根据盖斯定律,由(①②)×2可得:2C(s)+O2(g)
CO2(g) ΔH=283.0 kJ·mol1,根据盖斯定律,由(①②)×2可得:2C(s)+O2(g) ![]() 2CO(g) ΔH=(394.0 kJ·mol1+283.0 kJ·mol1)×2=222.0 kJ·mol1。
2CO(g) ΔH=(394.0 kJ·mol1+283.0 kJ·mol1)×2=222.0 kJ·mol1。
(4)①由表格中的平衡常数数据可知,温度越高,平衡常数越小,即升高温度,平衡逆向移动,故正反应为放热反应,即Q<0。②由题意可知,平衡时c(H2)=1.4 mol·L1,c(CO)=0.2 mol·L1,c(CH3OH)=0.8 mol·L1,则K=![]() ≈2.041 L2·mol2,v(CH3OH)=0.8 mol·L1÷10 min=0.08 mol·L1·min1。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p1<p2。达平衡状态A时,CO的转化率为0.5,此时CO为5 mol,H2为10 mol,CH3OH为5 mol;达平衡状态B时,CO的转化率为0.8,此时CO为2 mol,H2为4 mol,CH3OH为8 mol。由于温度相同,化学平衡常数相同。设V(B)为V L,则
≈2.041 L2·mol2,v(CH3OH)=0.8 mol·L1÷10 min=0.08 mol·L1·min1。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p1<p2。达平衡状态A时,CO的转化率为0.5,此时CO为5 mol,H2为10 mol,CH3OH为5 mol;达平衡状态B时,CO的转化率为0.8,此时CO为2 mol,H2为4 mol,CH3OH为8 mol。由于温度相同,化学平衡常数相同。设V(B)为V L,则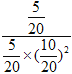 =
=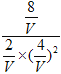 ,解得V=4。
,解得V=4。


科目:高中化学 来源: 题型:
【题目】电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。

(2)电解法处理酸性含铬废水(主要含有![]() )时,以铁板作阴、阳极,处理过程中存在反应
)时,以铁板作阴、阳极,处理过程中存在反应![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是______________________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解![]() 的原理如图所示。
的原理如图所示。

①电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s) ![]() BaS(s)+4CO(g) ΔH=+571.2 kJ·mol1
BaS(s)+4CO(g) ΔH=+571.2 kJ·mol1
BaS(s) ![]() Ba(s)+S(s) ΔH=+460 kJ·mol1
Ba(s)+S(s) ΔH=+460 kJ·mol1
已知:2C(s)+O2(g) ![]() 2CO(g) ΔH=221 kJ·mol1
2CO(g) ΔH=221 kJ·mol1
则:Ba(s)+S(s)+2O2(g) ![]() BaSO4(s) ΔH=_____________。
BaSO4(s) ΔH=_____________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图象如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
b.水电离出c(H+)=1×108 mol/L
c.c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )
)
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )

A. HX是强酸,溶液每稀释10倍,pH始终增大1
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a点大于b点
D. c 点溶液中:c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量CaCl2、MgCl2、Na2SO4等杂质,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下:

(1)欲除去溶液I中的杂质,写出A所代表的多种试剂,按滴加顺序依次为I. NaOH;II.____;III._________(填化学式)。
(2)请写出下列试剂加入时发生反应的化学方程式:
①加入试剂I:_______。 ②加入盐酸:_______。
(3)操作a、b中均用到的玻璃仪器是______(填仪器名称),操作c的名称为_____。
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____(从提供的试剂中选)。
(5)若上述流程中未进行操作b,即直接向溶液I中加盐酸到pH为4~5,过滤,得到沉淀X和溶液Y,则沉淀X为______(写离子符号),溶液Y仍含有的杂质金属离子是_______(写离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3溶于水含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染指数(API)是衡量空气质量好坏的指标,API数值越小,空气质量越好。API中涉及的污染物肯定不包括( )
A. N2 B. SO2
C. NO2 D. 可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青苹果汁遇碘水显蓝色,熟苹果汁能还原银氨溶液,这说明( )
A.青苹果中只含有淀粉而不含葡萄糖
B.熟苹果中只含有葡萄糖而不含淀粉
C.苹果转熟时淀粉水解为葡萄糖
D.苹果转熟时葡萄糖聚合成淀粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com