
����Ŀ����ⷨ�ڽ�������������������������ˮ������ʮ����Ҫ�����á�
��1����ͼΪ��⾫������ʾ��ͼ��________(��a��b)��Ϊ�������ʵĴ�������b������������ɫ�������ɣ������ɸ�����ĵ缫��ӦʽΪ______________________��

��2����ⷨ�������Ժ�����ˮ(��Ҫ����![]() )ʱ�����������������������������д��ڷ�Ӧ
)ʱ�����������������������������д��ڷ�Ӧ![]() ��6Fe2����14H��
��6Fe2����14H��![]() 2Cr3����6Fe3����7H2O�����Cr3����Cr(OH)3��ʽ��ȥ���ش��������⣺
2Cr3����6Fe3����7H2O�����Cr3����Cr(OH)3��ʽ��ȥ���ش��������⣺
��д���缫��Ӧʽ������________________������________________��
��������1 mol Cr(OH)3ʱ����·��ת�Ƶ��ӵ����ʵ�������Ϊ________mol��
������������Fe(OH)3�������ɣ�ԭ����______________________________________��
��3����⽵�ⷨ����������ˮ�������ε���Ⱦ����⽵��![]() ��ԭ����ͼ��ʾ��
��ԭ����ͼ��ʾ��

����Դ����Ϊ________(��A��B)��������ӦʽΪ______________________��
������������ת����2 mol���ӣ���Ĥ������Һ�������仯��(��m��m��)Ϊ________g��
���𰸡���1��a ![]() ��3e����4H��
��3e����4H��![]() NO����2H2O��
NO����2H2O��![]() ��e����2H��
��e����2H��![]() NO2����H2O
NO2����H2O
��2����2H����2e��![]() H2�� Fe��2e��
H2�� Fe��2e��![]() Fe2�� ��6 ���������ɵ�Fe2������Һ�е�
Fe2�� ��6 ���������ɵ�Fe2������Һ�е�![]() ����Fe3��������H���ŵ磬������Һ�е������½���ʹFe3����ˮ��ƽ�����ƣ�����Fe(OH)3����
����Fe3��������H���ŵ磬������Һ�е������½���ʹFe3����ˮ��ƽ�����ƣ�����Fe(OH)3����
��3����A 2![]() ��6H2O��10e��
��6H2O��10e��![]() N2����12OH�� ��14.4
N2����12OH�� ��14.4
��������������Ҫ�������ԭ����
��1������������������a��Ϊ�������ʵĴ�������b������������ɫ�������ɣ������ɸ�����ĵ缫��ӦʽΪ![]() ��3e����4H��
��3e����4H��![]() NO����2H2O��
NO����2H2O��![]() ��e����2H��
��e����2H��![]() NO2����H2O��
NO2����H2O��
��2�����缫��Ӧʽ������2H����2e��![]() H2��������Fe��2e��
H2��������Fe��2e��![]() Fe2����
Fe2����
��������1 mol Cr(OH)3ʱ������1 mol Cr3+������1 mol Cr3+������3 mol Fe2+����·��ת�Ƶ��ӵ����ʵ�������Ϊ6 mol��
������������Fe(OH)3�������ɣ�ԭ�����������ɵ�Fe2������Һ�е�![]() ����Fe3��������H���ŵ磬������Һ�е������½���ʹFe3����ˮ��ƽ�����ƣ�����Fe(OH)3������
����Fe3��������H���ŵ磬������Һ�е������½���ʹFe3����ˮ��ƽ�����ƣ�����Fe(OH)3������
��3��Ag��Pt�����������Ե�Դ����ΪA��![]() ��Ϊ����Ⱦ��N2��������ӦʽΪ2
��Ϊ����Ⱦ��N2��������ӦʽΪ2![]() ��6H2O��10e��
��6H2O��10e��![]() N2����12OH����
N2����12OH����
������������ӦΪ5H2O��10e��![]() 10H����
10H����![]() O2��������������ת����2 mol���ӣ����������ٵ�����Ϊ
O2��������������ת����2 mol���ӣ����������ٵ�����Ϊ![]() mol O2��������16 g���Ҳ�����������ٵ�����Ϊ
mol O2��������16 g���Ҳ�����������ٵ�����Ϊ![]() mol N2��������5.6 g��ͬʱ�����������ɵ�2 mol H��ͨ�����ӽ���Ĥ����������������Ĥ������Һ�������仯��(��m��m��)Ϊ(16+2)(5.62) g=14.4 g��
mol N2��������5.6 g��ͬʱ�����������ɵ�2 mol H��ͨ�����ӽ���Ĥ����������������Ĥ������Һ�������仯��(��m��m��)Ϊ(16+2)(5.62) g=14.4 g��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(12 ��)��ʽ�Ȼ�ͭ����Ҫ����ɱ������
��1����ʽ�Ȼ�ͭ�ж����Ʊ�����
������1: 45 ~ 50��ʱ,��CuCl����Һ�г���ͨ������õ�Cu2 (OH)2 Cl2��3H2O, �÷�Ӧ�Ļ�ѧ����ʽΪ_________________________��
������2: ���Ƶ�CuCl2,����ʯ���鷴Ӧ���ɼ�ʽ�Ȼ�ͭ��Cu��ϡ�����ڳ���ͨ������������·�Ӧ����CuCl2,Fe3+�Ը÷�Ӧ�д�����,���ԭ����ͼ��ʾ�� M'�Ļ�ѧʽΪ______��

��2����ʽ�Ȼ�ͭ�ж������,�ɱ�ʾΪCua(OH)bClc��xH2O�� Ϊ�ⶨij��ʽ�Ȼ�ͭ�����, ��������ʵ��: ����ȡ��Ʒ1.1160 g,������ϡHNO3�ܽ�����100.00 mL��ҺA; ��ȡ25. 00 mL��ҺA,��������AgNO3��Һ,��AgCl 0. 1722 g;����ȡ25. 00 mL��ҺA,����pH 4 ~ 5,��Ũ��Ϊ0.08000 mol��L-1��EDTA(Na2H2Y��2H2O)����Һ�ζ�Cu2+ (���ӷ���ʽΪCu2++ H2Y2-![]() CuY2-+2H+),�ζ����յ�,���ı���Һ30.00 mL��ͨ������ȷ������Ʒ�Ļ�ѧʽ(д���������)��
CuY2-+2H+),�ζ����յ�,���ı���Һ30.00 mL��ͨ������ȷ������Ʒ�Ļ�ѧʽ(д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��������ȷ����
A. �����£�pH��Ϊ4��H2SO4��(NH4)2SO4����Һ�У�ˮ�ĵ���̶���ͬ
B. ����ʱ��Ka��1��10-5Ũ��Ϊ0.1 mol/L��HA��Һ��pH��3
C. �ڱ���AgCl��AgBr�Ļ����Һ�м�������AgNO3��Һ ����
����
D. 25��ʱ����20 mL 0.01 mol/L�Ĵ�����Һ�еμ�10 mL 0.01 mol/L��KOH��Һ�������Һ������ԣ�c(K+) + c(H+)��c(CH3COOH) + c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��ϡ�н�����Ϊ���弰��ֲ��������Ԫ�أ������������Ͻ����ǿ�ȴ����¡���ĥ����ʴ�ȶ����е㣬�㷺Ӧ����ұ�𡢻�е�����������������Դ���������պ��������ij��ѧ��ȤС����ʵ����ģ���˴�ͭ�⾫����Ҫ����Cu2S��MoS2��SiO2��P��As�ȣ�����ȡ����õ�������Ĺ��̣�

��֪��MoO3��869.9K�¶��¿�ʼ����������969.9�¶��¼�������������Һ����H2MoO4��ʽ����
��1������1����Ҫ�ɷ�Ϊ_________________________��
��2��ͭ����е���Ԫ���ڹ����Ŀ����У���һ���¶��£�������������MoO3���䷽��ʽΪ___________________________________��
���չ�����Ӧ������800-870K���ң���ԭ��Ϊ____________________________��
��3��������Һ1�м����ͭ���Ƽ��ж��֣����軯�ƣ����ؽ������ӵ���Һ�������軯�ƣ����������ɳ��������������������軯�ƣ�����������CN-��Ӧ������[Me(CN)4]2-�ȶ��������ӣ������Ҫ�����軯�Ƶ���������д������Һ�м�������軯�Ƶ����ӷ���ʽ_______________________________��
���ɸ��軯���о綾��������Ҫ��ʣ����軯�ƽ��д�����ͨ��ѡ����Ư�ۻ�Ư��Һ�����������½�������Ϊ���ֿ����г��������壬��д��Ư��Һ���軯�Ʒ�Ӧ�����ӷ���ʽ_____��
�۳��軯���⣬���õ����Ƽ����������軯�ƣ�Na4[Fe(CN)6]�����ؽ��������ӷ�Ӧ�������ܶȻ���С�ij�������֪Cu2Fe(CN)6��Ksp=1.00��10-16����Һ�е�Cu2+��Ũ��ΪΪ0.5mol/L��.����Һ������Ũ��С�ڵ���1.00��10-16mol/Lʱ����Ϊ������ȫ����������IL��Һ��Na4[Fe(CN)6]���Ϊ_________������仯���Բ��ƣ�������λС������
��4����NH3��MoO3���ڻ��Դ���6��7ʱ���ɴӰ���Һ�нᾧ������ʽΪ(NH4)6Mo7O24 4H2O���Ρ�������Һ���Ѱ���ȥ�����к���Һ�����ϲ��ְ��������Դﵽ��һ�����������IΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ԭ����Ŀ�����ɴ�С˳�����е��ǣ� ��
��0.5mol NH3 �ڱ�״���� 22.4L He ��4��9mL ˮ ��0.2mol H3PO4
A. �٢ܢۢ� B. �ܢۢڢ� C. �ڢۢܢ� D. �٢ܢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��HSO3->I-��������IO3->I2���ں�3mol NaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ������˵������ȷ����
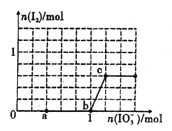
A. 0-a�η�����Ӧ��3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b�ι�����NaHSO3�����ʵ���Ϊ1.8mol
C. b~c�η�Ӧ����������ΪI2
D. ����Һ��I-��I2�����ʵ���֮��Ϊ5 : 1ʱ�������KIO3Ϊ1.lmol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A. ̼������Һ��ʯ���鷴Ӧ��CO32-+Ca2+=CaCO3��
B. ��������Һ��ʳ��ˮ��Ӧ��Ag++Cl-=AgCl��
C. ��NaOH��Һ��ͨ�������CO2��2OH-+CO2=CO32-+H2O
D. ���ˮ�еμ�FeCl3������Һ�Ʊ�Fe(OH)3���壺Fe3++3H2O![]() Fe(OH)3��+3H+
Fe(OH)3��+3H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ���������ǣ�������
A. �ǵ���ʣ��������ƾ������� B. ��ռ�����������
C. ����Ư�ۡ���ʯ�ҡ����� D. ���������CO2��SiO2��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯��������Դ�����ϵȷ�����й㷺����;���ش��������⣺
��1����Ȼ����ĿǰӦ�ý�Ϊ�㷺����Դ֮һ����Ȼ���г�����Ҫ�ɷּ����⣬���������顢����ȣ�����ĵ���ʽΪ ��
��2��̼��Ͳ����Ϊ��Ԫ���ᣬ������Ϊ�ֲ����룬���ߵĵ��볣�����±���
H2CO3 | H2C2O4 | |
K1 | 4.2��107 | 5.4��102 |
K2 | 5.6��1011 | 5.4��105 |
����̼������Һ�еμ�����������Һ��������Ӧ�����ӷ���ʽΪ ��
��Ũ�Ⱦ�Ϊ0.1 mol��L1��Na2CO3��Һ��NaHCO3��Һ��Na2C2O4��Һ��NaHC2O4��Һ������Һ��H+Ũ�ȷֱ����c1��c2��c3��c4����������Һ��H+Ũ���ɴ�С��˳��Ϊ ��
��3������ʱ��C��CO�ı�ȼ���ȷֱ�Ϊ394.0 kJ��mol1��283.0 kJ��mol1����������Cת��ΪCO���Ȼ�ѧ����ʽΪ ��
��4��������һ����̼��һ�������¿ɺϳɼ״�����Ӧ���£�
2H2(g)+CO(g)![]() CH3OH(g) ��H=Q kJ��mol1
CH3OH(g) ��H=Q kJ��mol1
���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)���±���
�¶�/�� | 250 | 300 | 350 |
K/L2��mol2 | 2.041 | 0.270 | 0.012 |
�ɴ˿��ж�Q (ѡ� >����<��)0��
��һ���¶��£���6 mol H2��2 mol CO�������Ϊ2 L���ܱ������У�10 min��Ӧ�ﵽƽ��״̬����ʱ���c(CO)=0.2 mol��L1�����¶��µ�ƽ�ⳣ��K= ��0~10 min�ڷ�Ӧ����v(CH3OH)= ��
���������ܱ������зֱ���20 mol H2��10 mol CO�����һ����̼��ƽ��ת�������¶�(T)��ѹǿ(p)�ı仯��ͼ��ʾ��

A��B�����ѹǿ��С��ϵ��p1 (ѡ� >������=����<��)p2����A���Ӧ�������ݻ�Ϊ20 L����B���Ӧ�������ݻ�Ϊ L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com