
【题目】钼是一种稀有金属,为人体及动植物必须的微量元素,纯金属钼和钼合金具有强度大、耐高温、耐磨损、耐腐蚀等多种有点,广泛应用于冶金、机械、化工、军工、电光源、润滑剂、航空航天等领域。某化学兴趣小组在实验室模拟了从铜钼精矿(主要含有Cu2S、MoS2,SiO2,P,As等)中提取分离得到氧化钼的过程:

已知:MoO3在869.9K温度下开始升华,而到969.9温度下激烈升华,在溶液中以H2MoO4形式存在
(1)滤渣1的主要成分为_________________________。
(2)铜钼矿中的钼元素在过量的空气中,于一定温度下,很容易氧化成MoO3,其方程式为___________________________________,
焙烧过程中应控制在800-870K左右,其原因为____________________________。
(3)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式_______________________________;
②由干氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用深漂白粉或漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式_____;
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;滤液中的Cu2+的浓度为为0.5mol/L、.当溶液中离子浓度小于等于1.00×10-16mol/L时可认为沉淀完全,则欲处理IL滤液的Na4[Fe(CN)6]体积为_________(体积变化忽略不计,保留两位小数)。
(4)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24 4H2O的盐。蒸发溶液(把氨除去)或中和溶液(化合部分氨)都可以达到这一比例。则操作I为_______。
【答案】 SiO2 2MoS2+ 7O2= 2MoO3+ 4SO2 温度过高回导致MoO3升华损失,温度过低会减慢反应速度 蒸发浓缩,冷却结晶 Cu2++4CN-=[Cu(CN)4]2- 2CN-+5ClO-+2H+=2CO2↑+5Cl+N2↑+H2O 2.89L
【解析】(1)铜钼精矿焙烧后得到固体主要成分是氧化铜、MoO3、SiO2等,其中只有二氧化硅不溶于酸,则滤渣1的主要成分为SiO2。(2)MoS2被氧气氧化为MoO3和SO2,反应的方程式为2MoS2+ 7O2=2MoO3+ 4SO2;由于温度过高会导致MoO3升华损失,而温度过低会减慢反应速度,所以焙烧过程中应控制在800~870K左右;(3)①铜离子与过量氰化钠反应的离子方程式为Cu2++4CN-=[Cu(CN)4]2-;②空气中常见无毒气体,根据原子守恒可知应该是氮气和CO2,则漂白液与氰化钠反应的离子方程式为2CN-+5ClO-+2H+=2CO2↑+5Cl+N2↑+H2O;③铜离子的物质的量是0.5mol,消耗0.25mol Na4[Fe(CN)6]。沉淀完全时[Fe(CN)6]4-的浓度是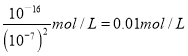 ,则0.25+0.01×(1+V)=0.1×V,解得V=2.89;(4)从滤液中得到(NH4)6Mo7O24 4H2O的操作I为蒸发浓缩,冷却结晶。
,则0.25+0.01×(1+V)=0.1×V,解得V=2.89;(4)从滤液中得到(NH4)6Mo7O24 4H2O的操作I为蒸发浓缩,冷却结晶。


科目:高中化学 来源: 题型:
【题目】 常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中: Fe3+、Mg2+、SCN –、Cl –
B. c(H+)/ c(OH–) = 1×10 -12的溶液中: K+、Na +、![]() 、
、![]()
C. c(Fe2+ ) =1 mol·L-1的溶液中: K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中: Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017海南卷]锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)用碳酸锂和_______反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为__________。
(2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是__________。
(3)硬脂酸锂是锂肥皂的主要成分,可作为高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是__________。
(4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF3和__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族和副族元素组成的是
A. 半导体材料砷化镓
B. 吸氢材料镧镍合金
C. 透明陶瓷材料硒化锌
D. 新型纳米材料氮化镓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用,其有效成分是( )
A. NaOH B. Na2O2 C. KMnO4 D. NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A. 自然界硅的贮量丰富
B. 自然界中存在大量单质硅
C. 二氧化硅被用于制作计算机芯片
D. 光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。

(2)电解法处理酸性含铬废水(主要含有![]() )时,以铁板作阴、阳极,处理过程中存在反应
)时,以铁板作阴、阳极,处理过程中存在反应![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是______________________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解![]() 的原理如图所示。
的原理如图所示。

①电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂。下列说法不正确的是

A. X元素位于周期表中的第16列
B. X的氢化物沸点一定高于Y的氢化物的沸点
C. X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制
D. X、Y、Z元素两两之间均能形成原子个数比为1 : 1的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )

A. HX是强酸,溶液每稀释10倍,pH始终增大1
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a点大于b点
D. c 点溶液中:c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com