
(12分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)乐山是国家级硅材料产业基地,硅材料是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。用氢气在高温下还原SiCl4是高纯硅生产过程中的一个环节,写出该反应的化学方程式 。
(2)大量使用化石燃料,最直接的危害是造成“温室效应”、“酸雨”等环境问题。为了防治酸雨,降低煤燃烧时向大气排放的SO2,某硫酸工厂上使用石灰乳吸收尾气,涉及的化学方程式为:
(3)汽车尾气中的NO、CO已经成为许多城市空气的主要污染源。但汽车的燃料中一般不含氮元素,尾气中的NO从何而来?写出有关化学方程式 ;治理汽车尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2,写出反应的化学方程式 。
(1) 玻璃
水泥(或其它合理答案)(各2分) 2H2 + SiCl4 Si + 4HCl(2分)
Si + 4HCl(2分)
(2) SO2 + Ca(OH)2 = CaSO3 + H2O(2分)
(3) N2 + O2 2NO(2分)
2NO + 2CO
2NO(2分)
2NO + 2CO 2CO2 + N2(2分)
2CO2 + N2(2分)
【解析】(1)常见的硅酸盐产品是水泥、玻璃和陶瓷等。氢气具有还原性,和斯氯化硅发生置换反应生成单质硅,方程式为2H2 + SiCl4 Si + 4HCl。
Si + 4HCl。
(2)SO2是酸性氧化物,和石灰乳反应生成亚硫酸钙和水,从而减少SO2的排放,方程式为SO2 + Ca(OH)2 = CaSO3 + H2O。
(3)由于在放电的条件下,氮气和氧气可以化合生成NO,方程式为N2 + O2 2NO。根据反应物和生成物可知,反应的方程式为2NO +
2CO
2NO。根据反应物和生成物可知,反应的方程式为2NO +
2CO 2CO2 + N2。
2CO2 + N2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
(12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:09~10年建湖二中高二下学期期末考试化学卷 题型:填空题
(12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |


查看答案和解析>>
科目:高中化学 来源:2011-2012年重庆西南大学附中高一下学期期中考试化学试卷(带解析) 题型:填空题
(12分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)乐山是国家级硅材料产业基地,硅材料是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。用氢气在高温下还原SiCl4是高纯硅生产过程中的一个环节,写出该反应的化学方程式 。
(2)大量使用化石燃料,最直接的危害是造成“温室效应”、“酸雨”等环境问题。为了防治酸雨,降低煤燃烧时向大气排放的SO2,某硫酸工厂上使用石灰乳吸收尾气,涉及的化学方程式为:
(3)汽车尾气中的NO、CO已经成为许多城市空气的主要污染源。但汽车的燃料中一般不含氮元素,尾气中的NO从何而来?写出有关化学方程式 ;治理汽车尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:09-10年建湖二中高二下学期期末考试化学卷 题型:填空题
(12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
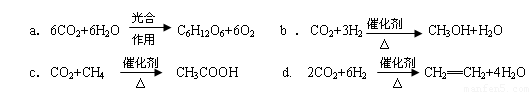
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
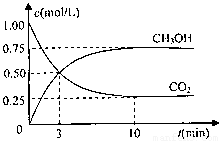
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
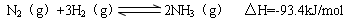
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
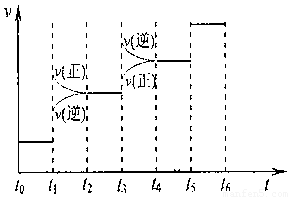
图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com