
【题目】电子工业中常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。流程图如下:

请回答:
(1)试剂A是_________ 。
(2)过程①反应的离子方程式是_________。
(3)过程③反应的离子方程式是_________。
(4)检验废液中Fe3+存在的方法是_________。
(5)若在10g滤渣中加入足量盐酸,放出1.12 L H2(标准状况),则滤渣中Cu的质量分数是______。
【答案】铁粉 Cu+2Fe3+=Cu2++2Fe2+ 2Fe2++Cl2=2Fe3++2Cl- 取少量废液于试管中,滴加KSCN溶液,若溶液变红,则说明废液中有Fe3+ 0.72(或72%)
【解析】
(1)过量的氯化铁溶液中加入镀铜电路板,发生Cu+2Fe3+=Cu2++2Fe2+,废液中含有Fe2+、Cu2+和过量的Fe3+;根据流程图,加入试剂A的目的是置换出铜,然后用盐酸除去过量的试剂A得到铜;分离得到的滤液中含有Fe2+,加入过量的试剂B得到氯化铁溶液,因此试剂B具有氧化性,据此分析解答。
(1)废液中铜以Cu2+形式存在的,要回收Cu应当选合适的还原剂还原,根据题意,应选铁粉,故答案为:铁粉;
(2)过程①是FeCl3溶液与铜反应,反应离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为;2Fe3++Cu=2Fe2++Cu2+;
(3)过程③是把滤液中的Fe2+再氧化为Fe3+;故需要通入氯气,反应的离子方程式为:2Fe2++Cl2=2Cl-+2Fe3+,故答案为:2Fe2++Cl2=2Cl-+2Fe3+;
(4)检验Fe3+常用KSCN溶液,故答案为:取少量废液与试管中,滴加KSCN溶液,若溶液变红色,说明废液中含有Fe3+;
(5)n(H2)=![]() =
=![]() =0.05mol,根据方程式:Fe+2H+=Fe2++H2↑,可得n(Fe)=0.05mol,则m(Fe)=nM=0.05mol ×56g/mol=2.8g,故m(Cu)=10g-2.8g=7.2g,所以则滤渣中Cu的质量分数=
=0.05mol,根据方程式:Fe+2H+=Fe2++H2↑,可得n(Fe)=0.05mol,则m(Fe)=nM=0.05mol ×56g/mol=2.8g,故m(Cu)=10g-2.8g=7.2g,所以则滤渣中Cu的质量分数=![]() ×100%=72%,故答案为72%。
×100%=72%,故答案为72%。


科目:高中化学 来源: 题型:
【题目】以氯酸钠等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法错误的是( )
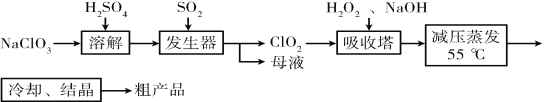
A.吸收塔中1mol H2O2失去2mol电子
B.吸收塔中温度不宜过高,否则会导致H2O2的分解
C.“母液”中含有大量的Na2SO4
D.溶解时能用盐酸代替硫酸以防止引入硫酸根杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某有机化合物A的结构,进行了如下实验:
(1)向NaHCO3溶液中加入A,有气体放出,说明A中含有___________官能团(写结构简式)。
(2)向NaOH溶液中加入少许A,加热一段时间后,冷却,用HNO3酸化后再滴加AgNO3溶液,产生淡黄色沉淀,说明中A还有___________官能团(写名称)。
(3)经质谱分析,Mr(A)=153,且A中只有四种元素,则A的分子式为___________。
(4)核磁共振氢谱显示,A的氢谱有3种,其强度之比为1︰2︰2,则A结构简式为___________。
(5)已知A可发生如下图所示的转化:
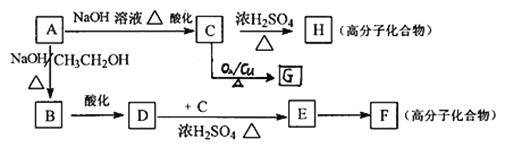
①A→B、D→E的反应类型分别为___________、___________。
②写出下列反应的化学方程式C→H:_________________________。
③C的同分异构体有多种,写出与C具有相同的官能团的C的同分异构体的结构简式:___________________________;写出F的结构简式:________________________。
④G与过量的银氨溶液反应,每生成2.16gAg,消耗G的物质的量是__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为气体化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。

则
(1)A的分子式是_________,甲的电子式是________。
(2)D的溶液与乙反应的离子方程式是________________。
(3)若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的比值等于2∶1的是
A. K2S溶液中c(K+)与c(S2-)之比
B. pH都为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比
C. 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比
D. 室温时,将pH=5的H2SO4溶液稀释1000倍,稀释后溶液中的c(H+)与c (SO42-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
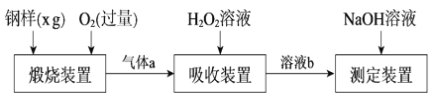
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一些重要的化学概念有下列说法,其中正确的是( )
①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的气化和液化都属于化学变化 ⑤置换反应都属于离子反应
A.①②⑤B.①②④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )

A. 反应中转移电子的物质的量是0.21mol
B. 一定有3. 36L氯气参加反应
C. 苛性钾溶液中KOH的质量是16.8g
D. ClO的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某Al2(SO4)3溶液VmL中含有a克Al3+,取出![]() mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
(2)在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则其中CO2所占的体积为______,CO所占的质量为______。
(3)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。
①配制该营养液后c(NH4+)=0.016mol/L,溶液中c(K+)=_______________。
②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com