
【题目】将潮湿的Cl2通入如图所示装置中,一段时间后乙装置中红色干燥布条褪色。则甲装置中所盛试剂(足量)可能是( )
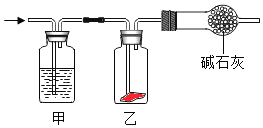
A.浓硫酸B.NaOH溶液C.KI溶液D.饱和食盐水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测,某工业废水显酸性,且废水中含有大量Na+、Cu2+、Cl-、SO42-、NO3-,
(1)下列离子中,不可能大量存在于该废水中的是___(填序号)。
A.K+ B.Fe3+ C.Ag+ D.HCO3-
(2)若向上述废水中加入大量的过氧化钠固体,观察到的现象为___;相关的离子方程式为___。
(3)若工业废水中只含有H+和Na+、Cu2+、Cl-、SO42-、NO3-,经分析测得,H+、Cu2+、Cl-、SO42-、NO3-的物质的量浓度分别为:0.1mol·L-1、0.05mol·L-1、0.2mol·L-1、0.1mol·L-1、0.1mol·L-1,则Na+的物质的量浓度为___。
(4)设计实验方案除去原废水中的Cu2+和SO42-(用流程图表示)(提示:加入的试剂要过量)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
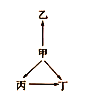
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | Fe | Fe3O4 | FeCl2 | FeCl3 |
D | S | FeS | SO2 | SO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(![]() )是有机合成过程中的中间体。
)是有机合成过程中的中间体。
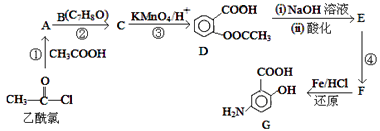
已知:Ⅰ.![]()
Ⅱ.![]() (具有较强的还原性)
(具有较强的还原性)
(1)反应④的试剂和条件为______;反应①的反应类型为______;反应②的作用是_____;
(2)B的结构简式为_______;
(3)下列关于G的描述正确的是______;
A.具有两性,既能与酸反应也能与碱反应
B.能发生加成、消去、取代和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_______;反应②的化学方程式为_________;
(5)符合下列条件的C的同分异构体
a.属于芳香族化合物,且含有两个甲基
b.既能发生银镜反应又能发生水解反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,某溶液X中所含ClO2浓度(g·L-1)的实验测定步骤如下:步骤1. 配制Na2S2O3溶液:准确称取1.984 0 g Na2S2O3·5H2O,用新煮沸并冷却的蒸馏水配成100.00 mL溶液。步骤2. 准确移取1.00 mL溶液X加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+===5I2+2Cl-+4H2O),在暗处放置5 min。步骤3. 向步骤2的锥形瓶的反应液中加入1 mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3===2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液25.00 mL。
(1)步骤1中所配Na2S2O3溶液的物质的量浓度为____mol·L-1,所用玻璃仪器除烧杯、胶头滴管外还有____。(2)配制Na2S2O3溶液时,蒸馏水需煮沸的原因是____。
(3)计算溶液X中所含ClO2浓度(g·L-1)(写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
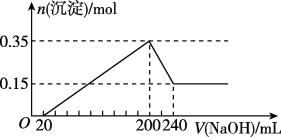
(1)原混合物中Mg和Al的质量之比为____。
(2)生成的H2在标准状况下的体积为____。
(3)加入NaOH溶液的物质的量浓度为____。
(4)稀硫酸的物质的量浓度为____。
(5)写出NaOH体积在200-240mL之间所发生的离子反应方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com