
【题目】将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
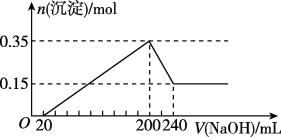
(1)原混合物中Mg和Al的质量之比为____。
(2)生成的H2在标准状况下的体积为____。
(3)加入NaOH溶液的物质的量浓度为____。
(4)稀硫酸的物质的量浓度为____。
(5)写出NaOH体积在200-240mL之间所发生的离子反应方程式____。
【答案】2∶3 10.08L 5mol/L 1.25mol/L Al(OH)3+OH-=AlO2-+2H2O
【解析】
由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:
H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,二者物质的量之和为
0.35mol,溶液中溶质为Na2SO4;从200mL到240mL,NaOH溶解Al(OH)3,NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=
240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为
0.35mol0.15mol=0.2mol。
(1)由元素守恒可知,n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的质量之比为:0.15mol×24g/mol:
0.2mol×27g/mol=2:3,故答案为:2:3;
(2)由A中可知,n(Al)=0.2mol,n(Mg)=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=
0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L,故答案为:10.08L;
(3)由200240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.2mol,氢氧化钠的浓度为:0.2mol/(0.24L0.2L)=5mol/L,故答案为:5mol/L;
(4)沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于240mL氢氧化钠溶液中含有的n(NaOH)的1/2倍,所以n(Na2SO4)=1/2×0.2L×5mol/L=0.5mol,所以硫酸的浓度为:0.5mol/0.4L=1.25mol/L,故答案为:1.25mol/L;
(5)从200mL到240mL,NaOH溶解Al(OH)3,NaOH+Al(OH)3=NaAlO2+2H2O,其离子反应方程式为:Al(OH)3+OH-=AlO2-+
2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】将潮湿的Cl2通入如图所示装置中,一段时间后乙装置中红色干燥布条褪色。则甲装置中所盛试剂(足量)可能是( )
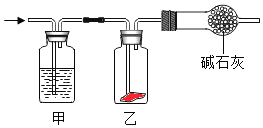
A.浓硫酸B.NaOH溶液C.KI溶液D.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)。
2Fe(s)+3CO2(g)。
(1)①该反应的平衡常数表达式为:K=___。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①___②___。
(3)明矾KAl(SO4)2·12H2O的水溶液呈___性(填”酸性、碱性、中性),溶液中各离子的浓度从大到小的顺序为____。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___,欲使上述体系中Al3+浓度增加,可加入的物质是____。
(5)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是____。
a. b.
b. c.
c. d.
d.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液逐滴加入0.2mol·L1的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1mol·L1
B. 通入CO2的体积为448mL
C. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1
D. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
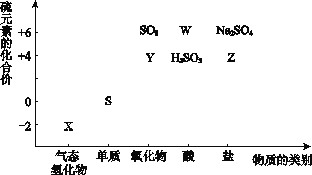
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,将0.1 mol 氢气、2.8 g一氧化碳和0.05 mol 氮气的混合气体与足量氧气充分燃烧后,立即将所得混合气体通过足量的过氧化钠粉末,固体质量增加
A.2.8 gB.3.0 gC.7.2 gD.5.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》杂志曾报道我国科学家设计的CO2熔盐捕获与转化装置,其示意图如下:
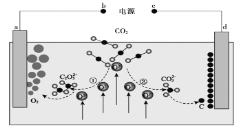
下列有关说法正确的是( )
A.d为负极
B.①②中,捕获CO2时碳元素的化合价发生了变化
C.转移1 mol电子可捕获CO2气体22.4 L
D.a极电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
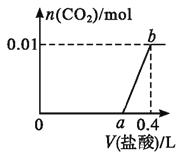
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com