
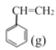
【题目】苯乙烯是一种重要的化工原料。工业中以乙苯![]() 为原料,采用催化脱氢的方法制取苯乙烯
为原料,采用催化脱氢的方法制取苯乙烯![]() 。回答下列问题:
。回答下列问题:
己知:①![]()
![]()
 +H2(g) △H1>0
+H2(g) △H1>0
②![]() △H2>0
△H2>0
(1)![]() +CO2(g)
+CO2(g)![]()
![]() +CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
+CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
a 高温 b 高压 c 低温 d 低压
(2)已知T1℃下,将1mol乙苯蒸气通入到体积为2L的密闭容器中进行反应①,容器内气体总物质的量随反应时间的变化情况如下表所示:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总物质的量n/mol | 1.0 | 1.4 | 1.65 | 1.8 | 1.8 |
①由表中数据计算0~10min内v(H2)=____:平衡时乙苯的转化率为____
②T1℃下该反应的平衡常数K1=____
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,则T1____T2(填“>”、 “<”或“=”)
【答案】△H1+△H2 ad 0.02molL-1min-1 80% 1.6 <
【解析】
根据盖斯定理,结合升高温度平衡向着吸热的方向移动,增大压强,平衡向着体积减小的方向移动来解答。
(1)根据盖斯定理,①+②可得:
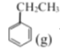 +CO2(g)
+CO2(g)![]()
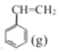 +CO(g)+H2O(g) △H=△H1+△H2,由△H1+△H2>0可知该反应为吸热反应,升高温度平衡向着吸热的方向移动,故选a。该反应是一个气体体积增大的反应,减小压强,平衡向着气体体积增大的方向移动,故选d。综上所述,ad符合要求。
+CO(g)+H2O(g) △H=△H1+△H2,由△H1+△H2>0可知该反应为吸热反应,升高温度平衡向着吸热的方向移动,故选a。该反应是一个气体体积增大的反应,减小压强,平衡向着气体体积增大的方向移动,故选d。综上所述,ad符合要求。
(2)①根据表中数据和反应①的特点可知,在0~10min内气体总物质的量增加了0.4mol,说明在这段时间内氢气的变化量也是0.4mol,则 ![]() ;平衡时气体总物质的量增加了0.8mol,所以平衡时乙苯的转化率为80%;
;平衡时气体总物质的量增加了0.8mol,所以平衡时乙苯的转化率为80%;
②T1℃下该反应的平衡常数K1= =1.6;
=1.6;
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,由于反应吸热,温度升高,平衡正向移动,K值变大,则T1<T2。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2),恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的ΔH>0
B.恒温恒容条件下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在2L密闭容器中加入一定量的MoS2、H2、Na2CO3发生反应:MoS2(s)+4H2(g) +2Na2CO3(s) ![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)。能说明该反应达到平衡状态的是
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)。能说明该反应达到平衡状态的是
A.![]()
B.容器内气体的密度不变
C.平衡常数K不变
D.CO与H2O的物质的量浓度的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有优良的杀菌效果,是一种理想的含氯杀菌剂替代品。以低碳钢板作为阳极电解浓氢氧化钠可以迅速制得高铁酸钠,其工作原理如图所示。下列说法正确的是
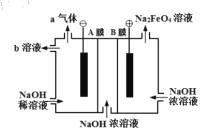
A.“A膜”、“B膜”分别为阴、阳离子交换膜
B.阴极区溶液的pH将减小
C.a气体为H2,,b溶液可循环使用
D.阳极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____(填字母)。
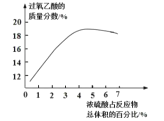
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:![]() )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____(用离子方程式表示)。
(4)滴定时所选指示剂为____;制得过氧乙酸溶液中过氧乙酸质量分数为____%。
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____(填标号)。
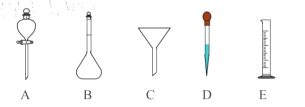
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:

已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞的形成主要源于石灰岩受地下水的长期溶蚀,发生反应:CaCO3+CO2+H2O=Ca(HCO3)2。当受热或压强突然减小时溶解的Ca(HCO3)2会分解,从而形成钟乳石、石笋等奇妙景观。
(1)写出Ca(HCO3)2受热分解的离子方程式____;从平衡移动的角度解释压强减小时Ca(HCO3)2分解的原因_______。
(2)向Ca(HCO3)2饱和溶液中滴加酚酞,溶液呈很浅的红色。由此可得到的结论是:饱和溶液中Ca(HCO3)2水解程度__________且___________。
(3)常温下,H2CO3的电离常数Ka2=4.7×10-11。若测得5.0×10-3 mol/L Ca(HCO3)2溶液的pH为8.0,则溶液中c(CO32-)与c(OH-)的比值为___________(简要写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com