
【题目】在研究金矿床物质组分的过程中,通过分析发现了Cu﹣Ni﹣Zn﹣Sn﹣Fe多金属互化物.
(1)某金属互化物属于晶体,区别晶体和非晶体可通过方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有性.
(2)基态Ni2+的核外电子排布式;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4 属于晶体.
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 . 1mol(SCN)2分子中含有σ键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是;
(4)立方NiO(氧化镍)晶体的结构如图﹣1所示,其晶胞边长为apm,列式表示NiO晶体的密度为g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)人工制备的NiO晶体中常存在缺陷(如图﹣2)一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 . 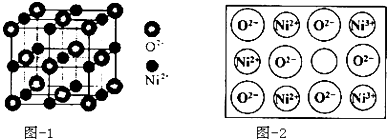
【答案】
(1)X﹣射线衍射实验;自范
(2)1s22s22p63s23p63d8;分子
(3)5NA;异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键
(4)![]() ;1:11
;1:11
【解析】解:(1)晶体和非晶体可通过X﹣射线衍射实验进行鉴别,金属互化物原子在三维空间里呈周期性有序排列,金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,所以答案是:X﹣射线衍射实验;自范;(2)Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2 , 失去4s能级2个电子形成Ni2+ , 故Ni2+离子核外电子排布为:1s22s22p63s23p63d8 , Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体,所以答案是:1s22s22p63s23p63d8;分子;(3)(SCN)2的结构式为N≡C﹣S﹣S﹣C≡N,根据[(SCN)2]的结构可知分子中有3个单键和2个碳氮三键,单键为σ键,三键含有1个σ键、2个π键,(SCN)2分子含有5个σ键,故1mol(SCN)2分子中含有σ键的数目为 5NA;由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸,所以答案是:5NA;异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;(4)晶胞中Ni原子数目为1+12× ![]() =4,氧原子数目为8×
=4,氧原子数目为8× ![]() +6×
+6× ![]() =4,晶胞质量为4×
=4,晶胞质量为4× ![]() g,晶胞边长为apm,晶胞体积为(a×10﹣10 cm)3 , NiO晶体的密度为为4×
g,晶胞边长为apm,晶胞体积为(a×10﹣10 cm)3 , NiO晶体的密度为为4× ![]() g÷(a×10﹣10 cm)3=
g÷(a×10﹣10 cm)3= ![]() g/cm3;设1mol Ni0.96O中含Ni3+xmol,Ni2+为(0.96﹣x)mol,根据晶体仍呈电中性,可知 3x+2×(0.96﹣x)=2×1,x=0.08mol Ni2+为(0.96﹣x)mol=0.88mol,即离子数之比为Ni3+:Ni2+=0.08:0.88=1:11,所以答案是:
g/cm3;设1mol Ni0.96O中含Ni3+xmol,Ni2+为(0.96﹣x)mol,根据晶体仍呈电中性,可知 3x+2×(0.96﹣x)=2×1,x=0.08mol Ni2+为(0.96﹣x)mol=0.88mol,即离子数之比为Ni3+:Ni2+=0.08:0.88=1:11,所以答案是: ![]() ;1:11.
;1:11.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 丁达尔效应不是胶体特有的现象,溶液与浊液也有
B. 胶体与其他分散系的本质区别是有丁达尔效应,而其他分散系没有
C. 胶体粒子的直径小于10-9m
D. 丁达尔效应可用于鉴别胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science 杂志在2017年春节发表了南京理工大学的论文,报道了世界上首个成功合成的五氮阴离子盐 (N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料中里程碑式的突破。该盐可简略表示如下,下列分析不合理的是( )
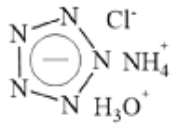
A. 五氮阴离子的化学式为 ![]() B. 该盐中氮元素的化合价均为-3价
B. 该盐中氮元素的化合价均为-3价
C. 该盐遇强碱能释放出NH3 D. 该盐中五氮阴离子具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.硝酸钾溶液能导电,所以硝酸钾溶液是电解质
B.石墨有较好的导电性,所以石墨属于电解质
C.液态氯化氢、固态氯化钠均不能导电,所以氯化氢、氯化钠均不是电解质
D.蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是( )
A.配制0.10molL﹣1NaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2 , 分出水层后的操作 | D.记录滴定终点读数为12.20mL |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
A.等于1.8 s
B.等于1.2 s
C.大于1.8 s
D.小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑩10种元素在元素周期表中的位置如图,请回答下列问题(用具体元素符号或化学式等化学用语填空).
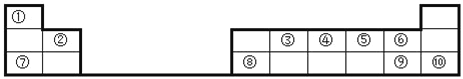
(1)10种元素中化学性质最稳定的是_____,非金属性最强的是______.
(2)上述元素的最高价氧化物对应水化物中酸性最强的是___________(填化学式).
(3)⑤⑥⑦⑧对应的简单离子中半径最小的是________(用离子符号表示).
(4)元素④的原子结构示意图是____________,工业上以④的氢化物为原料合成④的最高价氧化物对应水化物的化学方程式为___________________________。
(5)元素⑦最高价氧化物对应水化物与元素⑧的最高价氧化物对应水化物反应的离子方程式:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H 均为短周期元素、请回答下列问题:
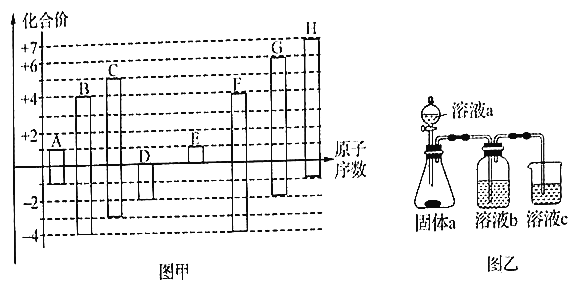
(1)F元素在周期表中的位置为________,A 和D形成的既有极性键又有非极性键的化合物,其电子式为________ 。
(2)D、E、G、H 的简单离子半径由大到小的顺序为(写化学式) ________ 。
(3)用电子式表示出E、H 两种元素组成的化合物的形成过程________ 。
(4)用乙图装置证明酸性:HCl>H2CO3>H2SiO3,则溶液b为________;溶液c中的离子方程式为________。下列事实可用于比较元素碳与Cl 非金属性相对强弱的是________。
a.最高正化合价Cl>C
b.C1的氢化物比C 的简单氢化物稳定
C.C1的氢化物比C 的简单氢化物沸点高
d.最高价氧化物的水化物的酸性:HC1O4>H2CO3
(5)A和D形成为18电子分子与A和G形成的13电了分子按4 :1的个数比反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com