
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
A.等于1.8 s
B.等于1.2 s
C.大于1.8 s
D.小于1.8 s
【答案】C
【解析】解:反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,即反应物的浓度变化为0.1﹣0.06=0.04molL﹣1 , v= ![]() =
= ![]() =0.02mol/(Ls),反应物的浓度由0.06molL﹣1降到0.024molL﹣ , 即反应物的浓度变化为0.06﹣0.024=0.036molL﹣1 , 若反应速率不变,则所需时间为
=0.02mol/(Ls),反应物的浓度由0.06molL﹣1降到0.024molL﹣ , 即反应物的浓度变化为0.06﹣0.024=0.036molL﹣1 , 若反应速率不变,则所需时间为 ![]() ×2=1.8s,但随着浓度的减小,反应速率逐渐减小,故所需时间大于1.8s, 故选C.
×2=1.8s,但随着浓度的减小,反应速率逐渐减小,故所需时间大于1.8s, 故选C.
【考点精析】根据题目的已知条件,利用反应速率的定量表示方法的相关知识可以得到问题的答案,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
A.等于1.8 s
B.等于1.2 s
C.大于1.8 s
D.小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了Cu﹣Ni﹣Zn﹣Sn﹣Fe多金属互化物.
(1)某金属互化物属于晶体,区别晶体和非晶体可通过方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有性.
(2)基态Ni2+的核外电子排布式;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4 属于晶体.
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2 . 1mol(SCN)2分子中含有σ键的数目为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是;
(4)立方NiO(氧化镍)晶体的结构如图﹣1所示,其晶胞边长为apm,列式表示NiO晶体的密度为g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)人工制备的NiO晶体中常存在缺陷(如图﹣2)一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 . 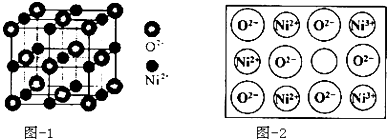
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、![]()
B. 通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、![]()
C. 通入足量CO2的溶液:H+、![]() 、Al3+、
、Al3+、![]()
D. 与铝反应产生大量氢气的溶液:Na+、K+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由 .
(3)完成以下氧化还原反应的离子方程式:MnO﹣4+C2O2﹣4+=Mn2++CO2↑+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 62g Na2O溶于水后所得溶液中含有O2-的离子数为NA
B. 50mL 12mol/L的浓盐酸与足量的MnO2充分反应后,转移电子数为0.3NA
C. 4.4 g D218O与T2O的混合物中所含中子数为2.4NA
D. 标准状况下,22.4L 氯气与足量的水反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用.有关转化关系如下: 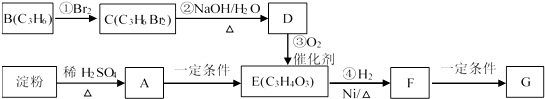
已知:CH3CH2CH2Br+NaOH→CH3CH2CH2OH+NaBr,淀粉在硫酸催化下水解生成葡萄糖.请回答下列问题:
(1)物质A的分子式为 , B的结构简式为;
(2)请写出F中含氧官能团的名称;
(3)反应①~④中属于加成反应的是;
(4)写出由两分子F合成六元环化合物的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com