
【题目】
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | HCl ②________ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥的后面。
(2)写出实验室由⑩制备O2的化学方程式:______________。
【答案】(1)②H2SO4(或HNO3、H2CO3); ③NaOH(或KOH);
⑥Na2SO4(或K2CO3、Na2SO3); (2) 2H2O2![]() 2H2O+O2↑.
2H2O+O2↑.
【解析】
试题分析:(1)②酸是电离出的阳离子全部是氢离子的化合物,所以Na、K、H、O、C、S、N中任两种或三种元素组成的酸有H2SO4、HNO3、H2CO3,答案为:H2SO4(或HNO3、H2CO3);③碱是电离出的阴离子全部是氢氧根离子的化合物,Na、K、H、O、C、S、N中任两种或三种元素组成的碱有NaOH、KOH,答案为:NaOH(或KOH);⑥盐是能够电离出金属阳离子或铵根离子和酸根离子的化合物,Na、K、H、O、C、S、N中任两种或三种元素组成的盐有Na2SO4、K2CO3、Na2SO3,答案为:Na2SO4(或K2CO3、Na2SO3);(2)过氧化氢在二氧化锰催化作用下产生氧气的化学方程式为:2H2O2![]() 2H2O+O2↑,答案为:2H2O2
2H2O+O2↑,答案为:2H2O2![]() 2H2O+O2↑.
2H2O+O2↑.


科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析以下说法 ,其中说法正确的是
①纯碱和熟石灰都是碱;②沼气和水蒸气都是可再生能源;
③冰和干冰既是纯净物又是化合物;④硫酸和食醋既是化合物又是酸;
⑤不锈钢和目前流通的硬币都是合金;⑥粗盐和酸雨都是混合物。
A.③⑤⑥ B.②④⑥ C.①③⑤ D.①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是
A. 气体A的平衡转化率大于气体B的平衡转化率
B. 物质D的聚集状态一定是气体
C. 平衡后升高温度,若平衡向左移动,则正反应的△H>0
D. 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图完成下列问题。
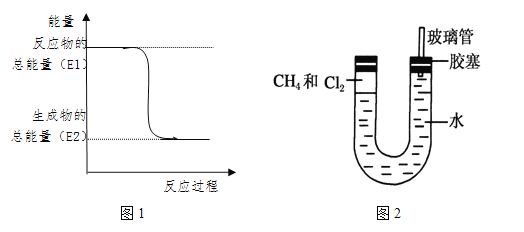
(1)“西气东输”中的“气”指天然气,其主要成分的结构式是__________。一定量的该气体燃烧过程的能量变化如图1所示,从图中可以读出E1 E2(填“>”或“<”),该反应_______ (填“放出”或“吸收”)能量。
(2)CH4和Cl2发生的一系列反应都是________(填反应类型)反应,请写出CH4和Cl2反应生成一氯甲烷的化学方程式:_______________________________。
(3)将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。经过几个小时的反应后,图2中U型管右端的玻璃管中水柱的变化是 (填“上升”或“下降”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,下列除去杂质的方法不正确的是
A.溴苯中混有溴,加稀氢氧化钠反复洗涤、分液
B.乙烯中混有SO2、CO2,将其通入NaOH溶液洗气
C.除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶
D.乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元求X、Y、W在元素周期表中的相对位置如下图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X | ||||||
Y | Z | W |
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W>X
C.简单离子半径的大小顺序:r(Y+)>r(X-)
D.Y、W的最高价氧化物的水化物均能溶解金厲Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷说法正确的是( )
A.甲烷在点燃前需进行验纯
B.甲烷能使酸性高锰酸钾溶液褪色
C.甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构
D.甲烷不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Favorskii反应是化工生产中的重要反应,它是利用炔烃与羰基化合物在强碱性下发生反应,得到炔醇,反应原理为:
以下合成路线是某化工厂生产流程的一部分:

已知:
请回答下列问题:
(1)写出F中官能团的名称 。
(2)写出D的名称(系统命名) 。
(3)④的反应类型是 ;B的结构简式是 。
(4)写出反应⑥的化学方程式为 。
(5)已知H与D互为同分异构体, H属于炔烃,其核磁共振氢谱有3种吸收峰,则H的结构简式为: (任写一种)。
(6)有关C的说法正确的是
a.能使溴的四氯化碳溶液褪色 b.能和氢氧化钠溶液反应
c.能使酸性高锰酸钾褪色 d.能与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。

(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______________微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com