
【题目】(化学---选修5有机化学基础)2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:
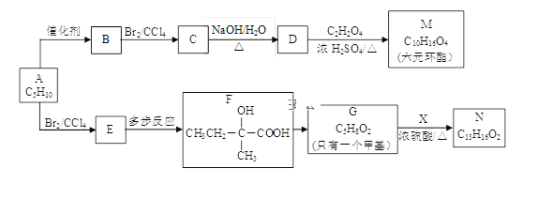
(1)按系统命名法,有机物A的名称是___________。
(2)B的结构简式是___________。
(3)写出D![]() M的化学方程式___________。
M的化学方程式___________。
(4)写出E![]() F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_________。
(6)满足下列条件的X的同分异构体共有_____种,写出任意一种的结构简式_____。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
【答案】2-甲基-1-丁烯 CH3CH2C(CH3)=C(CH3)CH2CH3 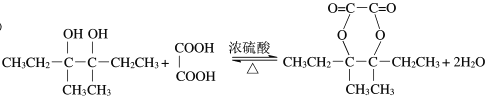 CH3CH2CBr(CH3)CH2Br
CH3CH2CBr(CH3)CH2Br ![]() CH3CH2COH(CH3)CH2OH
CH3CH2COH(CH3)CH2OH ![]() CH3CH2COH(CH3)CHO
CH3CH2COH(CH3)CHO![]()
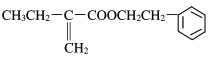 3
3 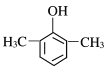
 (任写一种)
(任写一种)
【解析】
由F的结构简式可知A应为CH2=C(CH3)CH2CH3,生成E为CH2BrCBr(CH3)CH2CH3,F发生消去反应生成G,G为![]() ,X的苯环上只有一个取代基,且取代基无甲基,结合N的分子式可知N的结构简式为
,X的苯环上只有一个取代基,且取代基无甲基,结合N的分子式可知N的结构简式为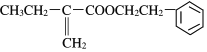 ,可知X为苯乙醇,由M的分子式可知D含有8个C,结合信息可知B为CH3CH2C(CH3)=C(CH3)CH2CH3,则C为CH3CH2CBr(CH3)CBr(CH3)CH2CH3,D为CH3CH2COH(CH3)COH(CH3)CH2CH3,M为
,可知X为苯乙醇,由M的分子式可知D含有8个C,结合信息可知B为CH3CH2C(CH3)=C(CH3)CH2CH3,则C为CH3CH2CBr(CH3)CBr(CH3)CH2CH3,D为CH3CH2COH(CH3)COH(CH3)CH2CH3,M为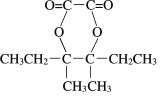 ,以此解答该题。
,以此解答该题。
(1)A为CH2=C(CH3)CH2CH3,名称为2-甲基-1-丁烯,故答案为:2-甲基-1-丁烯;
(2)由以上分析可知B为CH3CH2C(CH3)=C(CH3)CH2CH3,故答案为:CH3CH2C(CH3)=C(CH3)CH2CH3;
(3)D为CH3CH2COH(CH3)COH(CH3)CH2CH3,M为 ,反应的方程式为
,反应的方程式为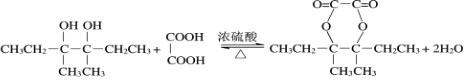 ,
,
故答案为: ;
;
(4)E为CH2BrCBr(CH3)CH2CH3,可先水解生成CH2OHCOH(CH3)CH2CH3,在铜催化条件下被氧化生成醛,然后与弱氧化剂反应生成酸,反应的流程为CH3CH2CBr(CH3)CH2Br ![]() CH3CH2COH(CH3)CH2OH
CH3CH2COH(CH3)CH2OH ![]() CH3CH2COH(CH3)CHO
CH3CH2COH(CH3)CHO![]()
 ,故答案为:CH3CH2CBr(CH3)CH2Br
,故答案为:CH3CH2CBr(CH3)CH2Br![]() CH3CH2COH(CH3)CH2OH
CH3CH2COH(CH3)CH2OH ![]() CH3CH2COH(CH3)CHO
CH3CH2COH(CH3)CHO![]()
 ;
;
(5)由以上分析可知N为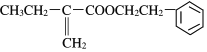 ,故答案为:
,故答案为: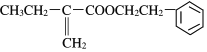 ;
;
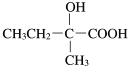
(6)X为苯乙醇,对应的同分异构体①遇FeCl3溶液显紫色,则羟基连接在苯环,②苯环上的一氯取代物只有两种,另一取代基为乙基,可为邻、间、对等结构,共3种,如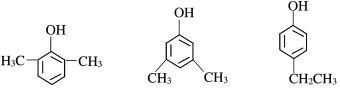 等,故答案为:3;
等,故答案为:3; (任写一种)。
(任写一种)。


科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是 ______,基态D原子价电子的轨道表达式为______。
(2)DA2分子的VSEPR模型是 ______。H2A比H2D熔、沸点高得多的原因是 ______。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
![]()
① C2Cl6属于_____晶体(填晶体类型),其中C原子的杂化轨道类型为_____杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是________。
(5)B、C的氟化物晶格能分别是2957 kJ·molˉ1、5492 kJ·molˉ1,二者相差很大的原因是_______
(6)D与E所形成化合物晶体的晶胞如图所示。在该晶胞中,E的配位数为___________。
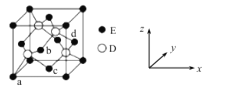
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将 0.09molCl2通入 100mL 含 a molNaI与 a mol Na2SO4的混合溶液中,有 0.25a mol的 NaI 被氧化(不考虑 Cl2 与 I2 之间的反应),则下列说法正确的是
A.物质的还原性 Iˉ >SO32ˉ
B.NaI 与 Na2SO3 的物质的量浓度为 0.08mol/L
C.通入 0.09molCl2 发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18Clˉ
D.若再通入0.07molCl2,恰好能将 NaI与 Na2SO3 完全氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质监测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。


(1)该同学应选择____mL的容量瓶。
(2)其操作步骤如图所示,则上图框中操作应在图中__________ (填选项字母)之间。
A.②与③ B.①与② C.③与④
(3)该同学应称取NaOH固体____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

(4)下列操作对所配溶液的浓度大小有何影响(填“偏大” “偏小”或“无影响”)。
①定容时,俯视读数,浓度会________;②转移溶液过程中,少量液体溅出来,浓度会____________;
③容量瓶未干燥,浓度会__________;
④定容摇匀后发现溶液凹面低于刻度线,浓度会______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲制取 NaHSO3 晶体,设计采用如下装置制备(省略夹持和加热装置)。
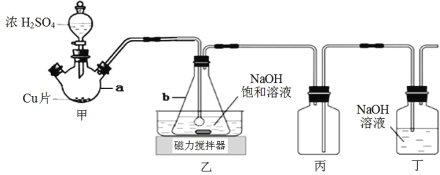
(1)仪器 b 的名称是_____________。
(2)装置丙的作用是_____________。
(3)装置乙中过量的 SO2 与 NaOH 溶液反应生成 NaHSO3 晶体,其离子方程式为_____________。
(4)装置甲中反应生成 SO2 的操作顺序是_____________。
①点燃酒精灯加热仪器 a
②打开分液漏斗上口玻璃塞
③打开分液漏斗玻璃旋塞,使浓硫酸流入 a
④关闭分液漏斗玻璃旋塞
(5)经检验,实验制得的 NaHSO3 晶体中含有大量的 Na2S2O5 固体和一定量的 Na2SO3 和Na2SO4,查阅资料获知在溶液中 NaHSO3 易发生反应生成 Na2S2O5,Na2S2O5 在空气中、受热时均易分解。
①试写出反应生成 Na2S2O5 的化学方程式_____________。
②晶体中含有 Na2SO3 和 Na2SO4 的可能原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、![]() 的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
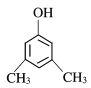
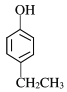
【题目】(1)今有如图所示的三种有机物:
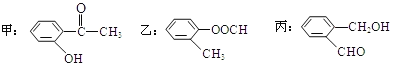
①写出丙中含氧官能团的名称___;
②这三种物质中,互为同分异构体的是___;
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
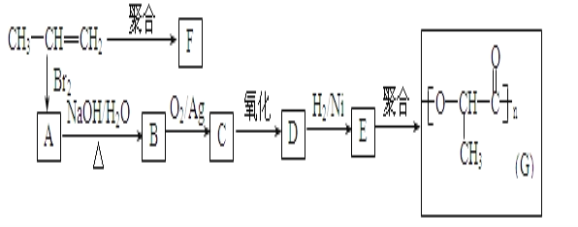
①A的同分异构体还有___种;
②聚合物F的结构简式是___;
③B转化为C的化学方程式是___;
④写出与E具有相同官能团的一种同分异构体的结构简式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com