
【题目】已知 SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将 0.09molCl2通入 100mL 含 a molNaI与 a mol Na2SO4的混合溶液中,有 0.25a mol的 NaI 被氧化(不考虑 Cl2 与 I2 之间的反应),则下列说法正确的是
A.物质的还原性 Iˉ >SO32ˉ
B.NaI 与 Na2SO3 的物质的量浓度为 0.08mol/L
C.通入 0.09molCl2 发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18Clˉ
D.若再通入0.07molCl2,恰好能将 NaI与 Na2SO3 完全氧化
【答案】C
【解析】
由信息可知还原性:![]() >I-,通入Cl2先发生
>I-,通入Cl2先发生![]() +Cl2+H2O=
+Cl2+H2O=![]() +2H++2Cl-,有0.25amol的NaI被氧化,由电子守恒可知,此时发生8
+2H++2Cl-,有0.25amol的NaI被氧化,由电子守恒可知,此时发生8![]() +2I-+9Cl2+8H2O=8
+2I-+9Cl2+8H2O=8![]() +I2+16H++18Cl-,以此来解答。
+I2+16H++18Cl-,以此来解答。
A.由![]() +I2+H2O═
+I2+H2O═![]() +2I-+2H+可知,S元素的化合价升高.I元素的化合价降低,则还原性:
+2I-+2H+可知,S元素的化合价升高.I元素的化合价降低,则还原性:![]() >I-,故A错误;
>I-,故A错误;
B.由电子守恒可知,0.09mol×2=amol×(6-4)+0.25amol,a=0.08mol,NaI与Na2SO3的物质的量浓度为c=0.8mol/L,故B错误;
C.通入0.09molCl2发生反应时有0.25amol的NaI被氧化,则离子方程式为:8![]() +2I-+9Cl-+8H2O═8
+2I-+9Cl-+8H2O═8![]() +I-+16H++18Cl-,故C正确;
+I-+16H++18Cl-,故C正确;
D.若再通入0.07molCl2,由还原性及电子守恒可知,Na2SO3还有0.01mol未被氧化,故D错误;
故选:C。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
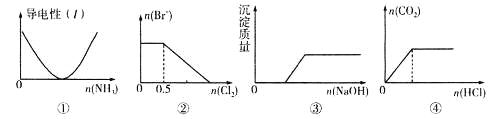
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几种类推结论符合事实的是
A.氯水可以将 Fe2+氧化至 Fe3+,则碘水也可以将 Fe2+氧化至 Fe3+
B.Fe3O4 可改写为 FeO·Fe2O3,则 Fe3Cl8 也可改写为 FeCl2·2FeCl3
C.Cl2+H2OHCl+HClO 是氧化还原反应,则 ICl+H2OHCl+HIO 也是氧化还原反应
D.CO2 溶于 H2O 生成 H2CO3,则 SiO2 也能溶于 H2O 生成 H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al2(SO4)3和Na2SO4的混合溶液V L,将它均分成两份。一份滴加氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO![]() 完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合溶液中的c(Na+)(mol·L-1)为( )
完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合溶液中的c(Na+)(mol·L-1)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修5有机化学基础)2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:
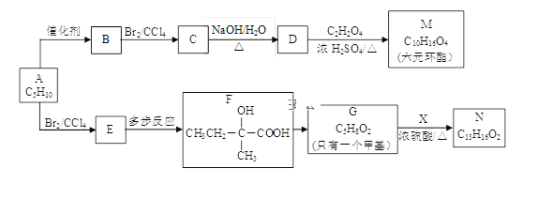
(1)按系统命名法,有机物A的名称是___________。
(2)B的结构简式是___________。
(3)写出D![]() M的化学方程式___________。
M的化学方程式___________。
(4)写出E![]() F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_________。
(6)满足下列条件的X的同分异构体共有_____种,写出任意一种的结构简式_____。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然碱可以看作是CO2 和 NaOH 反应后的产物组成的一种物质。为了研究该物质的组成,进行如下实验:
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是_____________。
②天然碱的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将可称量的物质与难以称量的微观粒子之间联系起来,国际上采用了“物质的量”这一物理量,据此完成下列试题:
(1)等质量的O2和O3所含分子的物质的量之比为___。
(2)等温等压下,等体积的O2和O3所含分子个数比为___,质量比为___。
(3)设NA为阿伏加德罗常数的值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___(用含a、b、c、NA的式子表示)。
(4)实验室需要配制100mL1mol/L的NaOH溶液,进行如下操作:
①配制该溶液所需主要仪器除了托盘天平、玻璃棒、烧杯、胶头滴管,还需要的玻璃仪器___。
②计算需要NaOH固体的质量:___g。
③取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为___。
④若出现如下情况,导致所配溶液浓度偏高的是___。
A.称量时砝码已经生锈
B.定容时仰视
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作
D.定容摇匀后,液面低于容量瓶颈上的刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com