
【题目】某天然碱可以看作是CO2 和 NaOH 反应后的产物组成的一种物质。为了研究该物质的组成,进行如下实验:
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是_____________。
②天然碱的化学式是_____________。
【答案】1.2mol/L 2Na2CO32NaHCO3H2O
【解析】
天然碱加热分解生成CO2,说明含有NaHCO3,NaHCO3分解生成的CO2.H2O的物质的量相等,而实际分解生成的水比二氧化碳的多,说明天然碱还含有结晶水。相同质量的天然碱加入足量盐酸,生成CO2的体积大于加热分解生成的CO2的体积,说明还含有Na2CO3;
①根据分解生成二氧化碳条件可以计算碳酸氢钠的物质的量,由加酸生成二氧化碳体积,根据碳原子守恒计算碳酸钠的物质的量,加入的盐酸恰好反应时盐酸的物质的量浓度最小,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒计算HCl的物质的量,进而计算盐酸的最小浓度;
②计算天然碱中碳酸钠、碳酸氢钠、结晶水的物质的量比例关系,可得天然碱的化学式。
天然碱加热分解生成CO2,说明含有NaHCO3,分解生成的CO2为![]() =0.01mol,分解生成H2O为
=0.01mol,分解生成H2O为![]() =0.02mol,由2NaHCO3
=0.02mol,由2NaHCO3![]() Na2CO3+CO2↑+H2O可知,天然碱还含有结晶水,相同质量的天然碱加入足量盐酸,生成CO2的体积大于加热分解生成的CO2的体积,说明还含有Na2CO3。
Na2CO3+CO2↑+H2O可知,天然碱还含有结晶水,相同质量的天然碱加入足量盐酸,生成CO2的体积大于加热分解生成的CO2的体积,说明还含有Na2CO3。
①分解生成二氧化碳为0.01mol,则碳酸氢钠为0.01mol×2=0.02mol。加酸生成二氧化碳总物质的量为:![]() =0.04mol,由碳原子守恒可知,碳酸钠物质的量为:0.04mol-0.02mol=0.02mol。加入的盐酸恰好反应时盐酸的物质的量浓度最小,此时溶液中溶质为NaCl,根据钠离子.氯离子守恒:n(HCl)=n(NaCl)=0.02mol×2+0.02mol=0.05mol,故盐酸的最小浓度为:
=0.04mol,由碳原子守恒可知,碳酸钠物质的量为:0.04mol-0.02mol=0.02mol。加入的盐酸恰好反应时盐酸的物质的量浓度最小,此时溶液中溶质为NaCl,根据钠离子.氯离子守恒:n(HCl)=n(NaCl)=0.02mol×2+0.02mol=0.05mol,故盐酸的最小浓度为:![]() =1.2mol/L,
=1.2mol/L,
故答案为:1.2mol/L;
②由方程式可知碳酸氢钠分解生成水为0.01mol,故结晶水的物质的量为0.02mol-0.01mol=0.01mol,则n(Na2CO3):n(NaHCO3):n(H2O)=0.02mol:0.02mol:0.01mol=2:2:1,故该天然碱的组成为:2Na2CO32NaHCO3H2O,
故答案为:2Na2CO32NaHCO3H2O。


科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。下列说法不正确的是( )
A.还原性:NaN3 > N2
B.若有65 g NaN3参加反应,则生成的N2的物质的量为1.6 mol
C.每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D.被还原的N与被氧化的N为15 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将 0.09molCl2通入 100mL 含 a molNaI与 a mol Na2SO4的混合溶液中,有 0.25a mol的 NaI 被氧化(不考虑 Cl2 与 I2 之间的反应),则下列说法正确的是
A.物质的还原性 Iˉ >SO32ˉ
B.NaI 与 Na2SO3 的物质的量浓度为 0.08mol/L
C.通入 0.09molCl2 发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18Clˉ
D.若再通入0.07molCl2,恰好能将 NaI与 Na2SO3 完全氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲制取 NaHSO3 晶体,设计采用如下装置制备(省略夹持和加热装置)。
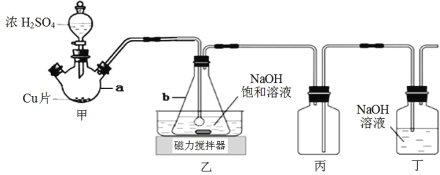
(1)仪器 b 的名称是_____________。
(2)装置丙的作用是_____________。
(3)装置乙中过量的 SO2 与 NaOH 溶液反应生成 NaHSO3 晶体,其离子方程式为_____________。
(4)装置甲中反应生成 SO2 的操作顺序是_____________。
①点燃酒精灯加热仪器 a
②打开分液漏斗上口玻璃塞
③打开分液漏斗玻璃旋塞,使浓硫酸流入 a
④关闭分液漏斗玻璃旋塞
(5)经检验,实验制得的 NaHSO3 晶体中含有大量的 Na2S2O5 固体和一定量的 Na2SO3 和Na2SO4,查阅资料获知在溶液中 NaHSO3 易发生反应生成 Na2S2O5,Na2S2O5 在空气中、受热时均易分解。
①试写出反应生成 Na2S2O5 的化学方程式_____________。
②晶体中含有 Na2SO3 和 Na2SO4 的可能原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、![]() 的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
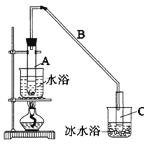
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: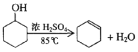
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是:_______________,导管B除了导气外还具有的作用是:_______________。
②试管C置于冰水浴中的目的是。:_______________
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在:_______________层(填上或下),分液后用:_______________ (填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊溶液中,可以观察到的现象是_________;
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒。请写出氯气与水反应的化学方程式:___________,在该反应中氧化产物是_________,还原产物是____________。
(3)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。其反应原理为(用化学方程式表示):_________。
(4)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用:
①该同学应称取NaOH固体__________ g;
②上述实验除了需要托盘天平、药匙、烧杯、玻璃棒、量筒等仪器外,还需要的仪器有_______。
③下列操作使配制的NaOH溶液浓度偏低的有__________。
A.将砝码放在左盘上,NaOH放在右盘上进行称量
B.定容的仰视刻度线
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
(5)取上述配制的NaOH溶液______ L才能与0.224 L 氯气(标准状况下)恰好完全反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com