
【题目】某实验小组欲制取 NaHSO3 晶体,设计采用如下装置制备(省略夹持和加热装置)。
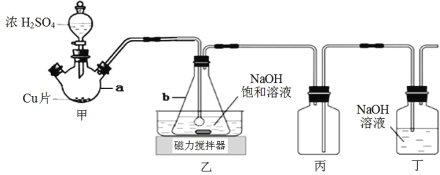
(1)仪器 b 的名称是_____________。
(2)装置丙的作用是_____________。
(3)装置乙中过量的 SO2 与 NaOH 溶液反应生成 NaHSO3 晶体,其离子方程式为_____________。
(4)装置甲中反应生成 SO2 的操作顺序是_____________。
①点燃酒精灯加热仪器 a
②打开分液漏斗上口玻璃塞
③打开分液漏斗玻璃旋塞,使浓硫酸流入 a
④关闭分液漏斗玻璃旋塞
(5)经检验,实验制得的 NaHSO3 晶体中含有大量的 Na2S2O5 固体和一定量的 Na2SO3 和Na2SO4,查阅资料获知在溶液中 NaHSO3 易发生反应生成 Na2S2O5,Na2S2O5 在空气中、受热时均易分解。
①试写出反应生成 Na2S2O5 的化学方程式_____________。
②晶体中含有 Na2SO3 和 Na2SO4 的可能原因是_____________。
【答案】锥形瓶 安全瓶,防止倒吸 SO2+Na++OH-═NaHSO3↓ ②③④① 2NaHSO3═Na2S2O5+H2O Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4
【解析】
(1)根据常见仪器的名称结合该仪器的特征解答;
(2)根据图示可知气体通过一个集气瓶再与液体接触,发生倒吸时,液体会进入集气瓶中,从而从导气管进入左侧的集气瓶,据此分析用途;
(3)装置乙中过量的SO2与NaOH溶液反应生成NaHSO3晶体,NaHSO3晶体为沉淀,根据方程式书写;
(4)装置甲中反应生成SO2,先将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,保证压强上下一样,后打开分液漏斗玻璃旋塞,关闭分液漏斗玻璃旋塞后,再点燃酒精灯加热仪器a,防止生成的二氧化硫从上口逸出;
(5)①在溶液中NaHSO3易发生反应生成Na2S2O5,根据原子守恒还有水生成;
②Na2S2O5在空气中.受热时均易分解,亚硫酸钠中+4价的硫易被氧化成+6价。
(1)该仪器外观呈平底圆锥状,下阔上狭,有一圆柱形颈部,上方有一较颈部阔的开口,为锥形瓶,
故答案为:锥形瓶;
(2)二氧化硫极易溶于NaOH溶液,易发生倒吸,图示可知二氧化硫气体通过一个集气瓶再与NaOH溶液接触,发生倒吸时,液体会进入集气瓶中,从而从导气管进入左侧的集气瓶,所以装置丙的作用是安全瓶,防止倒吸,
故答案为:安全瓶,防止倒吸;
(3)乙装置:二氧化硫与氢氧化钠反应生成亚硫酸氢钠,反应为:SO2+NaOH═NaHSO3↓,其离子方程式为:SO2+Na++OH-═NaHSO3↓,
故答案为:SO2+Na++OH-═NaHSO3↓;
(4)装置甲中反应生成SO2,放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔使分液漏斗内外大气相通,便于液体流出,选②,打开分液漏斗玻璃旋塞,使浓硫酸流入a,选③,后打开分液漏斗玻璃旋塞,关闭分液漏斗玻璃旋塞后选④,再点燃酒精灯加热仪器a选①,防止生成的二氧化硫从上口逸出,所以操作顺序是②③④①,
故答案为:②③④①;
(5)①在溶液中NaHSO3易发生反应生成Na2S2O5,根据原子守恒产物还有水,反应为:2NaHSO3═Na2S2O5+H2O,
故答案为:2NaHSO3═Na2S2O5+H2O;
②Na2S2O5在空气中.受热时均易分解,分解生成生Na2SO3,晶体中含有Na2SO3,Na2SO3被氧化生成Na2SO4,
故答案为:Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4。


科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________。
(2)“滤渣Ⅰ”的主要成分为__(填化学式),该物质在工业上的用途为_________(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________。
(4)“氨解”发生反应的离子方程式为________。“净化”时通入H2S的目的是_______。
(5)“氧化”时发生反应的化学方程式为_________。
(6)“系列操作”具体是指_________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几种类推结论符合事实的是
A.氯水可以将 Fe2+氧化至 Fe3+,则碘水也可以将 Fe2+氧化至 Fe3+
B.Fe3O4 可改写为 FeO·Fe2O3,则 Fe3Cl8 也可改写为 FeCl2·2FeCl3
C.Cl2+H2OHCl+HClO 是氧化还原反应,则 ICl+H2OHCl+HIO 也是氧化还原反应
D.CO2 溶于 H2O 生成 H2CO3,则 SiO2 也能溶于 H2O 生成 H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修5有机化学基础)2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:
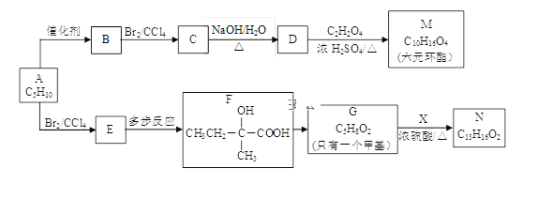
(1)按系统命名法,有机物A的名称是___________。
(2)B的结构简式是___________。
(3)写出D![]() M的化学方程式___________。
M的化学方程式___________。
(4)写出E![]() F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_________。
(6)满足下列条件的X的同分异构体共有_____种,写出任意一种的结构简式_____。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然碱可以看作是CO2 和 NaOH 反应后的产物组成的一种物质。为了研究该物质的组成,进行如下实验:
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是_____________。
②天然碱的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
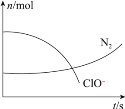
A.当有3molClO-参加反应时,则有1molN2生成
B.HCO3-作为碱性介质参与反应
C.当有5molClO-参加反应时,则有1molN2生成
D.若生成2.24LN2,则转移电子0.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二溴乙烷和水、溴苯和水、硝基苯和水三对物质都能用分液漏斗进行分离
B.苯与甲烷都不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色,则苯环使得甲基活化
C.甲苯与足量![]() 加成的产物的一氯代物有5种同分异构体
加成的产物的一氯代物有5种同分异构体
D.在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,会有沉淀析出,则溴乙烷在碱性条件下能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com