
【题目】某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
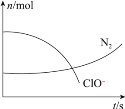
A.当有3molClO-参加反应时,则有1molN2生成
B.HCO3-作为碱性介质参与反应
C.当有5molClO-参加反应时,则有1molN2生成
D.若生成2.24LN2,则转移电子0.6mol
【答案】C
【解析】
由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物,则反应方程式为![]() 。
。
A. 由方程式可知,当有5molClO-参加反应时,则有1molN2生成,故A错误;
B. 由方程式可知,HCO3是生成物,故B错误;
C. 由方程式可知,当有5mol ClO-参加反应时,则有1molN2生成,故C正确;
D. 没有说明是标准状况,所以气体的物质的量无法计算,则转移电子无法计算,故D错误。
故答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则稀氨水和稀盐酸反应生成1mol水时,放出的能量小于57.3kJ
B.已知25℃,101kPa时,氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式可表示为:H2(g)+![]() O2(g)=H2O(g) △H=-285.8kJ/mol
O2(g)=H2O(g) △H=-285.8kJ/mol
C.已知25℃,101kPa时,石墨的燃烧热为393.5kJ/mol,则石墨燃烧的热化学方程式可表示为:C+O2=CO2 △H=-393.5kJ/mol
D.Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质监测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。


(1)该同学应选择____mL的容量瓶。
(2)其操作步骤如图所示,则上图框中操作应在图中__________ (填选项字母)之间。
A.②与③ B.①与② C.③与④
(3)该同学应称取NaOH固体____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

(4)下列操作对所配溶液的浓度大小有何影响(填“偏大” “偏小”或“无影响”)。
①定容时,俯视读数,浓度会________;②转移溶液过程中,少量液体溅出来,浓度会____________;
③容量瓶未干燥,浓度会__________;
④定容摇匀后发现溶液凹面低于刻度线,浓度会______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲制取 NaHSO3 晶体,设计采用如下装置制备(省略夹持和加热装置)。
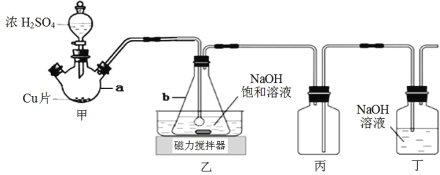
(1)仪器 b 的名称是_____________。
(2)装置丙的作用是_____________。
(3)装置乙中过量的 SO2 与 NaOH 溶液反应生成 NaHSO3 晶体,其离子方程式为_____________。
(4)装置甲中反应生成 SO2 的操作顺序是_____________。
①点燃酒精灯加热仪器 a
②打开分液漏斗上口玻璃塞
③打开分液漏斗玻璃旋塞,使浓硫酸流入 a
④关闭分液漏斗玻璃旋塞
(5)经检验,实验制得的 NaHSO3 晶体中含有大量的 Na2S2O5 固体和一定量的 Na2SO3 和Na2SO4,查阅资料获知在溶液中 NaHSO3 易发生反应生成 Na2S2O5,Na2S2O5 在空气中、受热时均易分解。
①试写出反应生成 Na2S2O5 的化学方程式_____________。
②晶体中含有 Na2SO3 和 Na2SO4 的可能原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为金属单质,B、C、D、E 四种均为含有氯元素的物质,它们存在如图转化关系(部分产物已略去,有的反应在溶液中进行)。请回答:

(1)A 是_____________,C 是_____________。(均用化学式表示)
(2)写出实验室制备 D 的化学方程式:_____________。
(3)写出用 B 溶液与 Cu 反应制作印刷电路板的离子方程式:_____________。
(4)设计实验方案,检验 C 溶液中的金属阳离子:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、![]() 的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”,用于药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
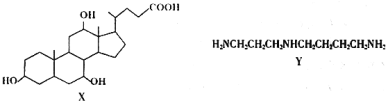
下列叙述错误的是( )
A.X的分子式为![]()
B.1mol X在浓硫酸作用下发生消去反应,最多生成3 mol ![]()
C.X与HBr的反应为消去反应
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的结构及性质说法错误的是( )
A.2-丁烯是石油裂解的产物之一,它存在顺反异构
B.乙酸、苯酚、乙醇都可以与金属钠反应产生氢气,所以它们都是电解质
C.该有机物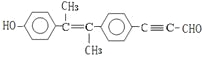 中,最多有19个碳原子共面
中,最多有19个碳原子共面
D.甲苯的硝化反应能说明侧链对苯环的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①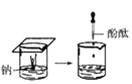 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②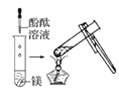 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③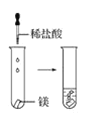 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④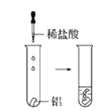 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com